Можно ли получить пероксид водорода взаимодействием водорода и кислорода
Содержание статьи
Получение, строение и свойства пероксида водорода
Задача 797.
Указать способы получения пероксида водорода, привести уравнения реакций.
Решение:
В промышленности пероксид водорода получают электрохимическим методами, например, анодным окислением растворов H2SO4 или (NH4)HSO4 с последующим гидролизом образующейся при этом пероксодвусерной ислоты H2S2O8.
При электролизе H2SO4 (50% раствор) на катоде разряжаются ионы водорода Н+, а на аноде — HSО4-. Последние, теряя свои заряды, соединяясь попарно, образуют перокусодвусерную кислоту:
На катоде: 2Н+ + 2 = Н2↑;
На аноде: 2HSО4- — 2 = H2S2O8,
или 2H2SO4 = H2S2O8 + 2H+ + 2.
Молекулярная форма:
2H2SO4 = H2S2O8 + Н2↑.
При электролизе (NH4)HSO4 на катоде разряжается молекулы воды, а на аноде — HSО4- . Последние, теряя свои заряды, соединяясь попарно, образуют перокусодвусерную кислоту:
На катоде: 2Н2О + 2 = Н2↑ +2ОН-;
На аноде: 2HSО4- — 2 = H2S2O8,
Молекулярная форма:
2(NH4)HSO4 + 2H2O = H2S2O8 + 2NH4OH + H2↑.
Далее перокидвусерная кислота подвергается гидролизу, сопровождающемуся образованием серной кислоты и пероксида водорода:
H2S2O8 + 2Н2О = 2H2SO4 + Н2О2.
Фактически электролиз протекает до тех пор пока в рабочем растворе не закончится или H2SO4, или (NH4)HSO4.
Задача 798.
Можно ли получить Н2О2. непосредственным взаимодействием водорода и кислорода? Ответ обосновать.
Решение:
Пероксид водорода образуется в качестве промежуточного продукта при горении водорода:
Н2 + О2 = Н2О2.
Но ввиду высокой температуры водородного пламени тотчас же разлагается на воду и кислород (2Н2О2 ) ⇔ 2Н2О + О2). Однако, если направить водородное пламя на кусок льда, то в образующейся воде можно обнаружить следы пероксида водорода. Пероксид водорода можно получить при действии атомарного водорода на кислород.
2Н + О2 = Н2О2.
Таким образом, непосредственным взаимодействием водорода и кислорода пероксид водорода невыгодно получать ни в лаборатории, ни в промышленности.
Задача 799.
Описать строение молекулы Н2О2. Почему эта молекула полярна?
Решение:
Молекула H2O2 неплоская, имеет строение H−O−O−H с -связью O−O на ребре и связями H-O на плоскостях двугранного угла:
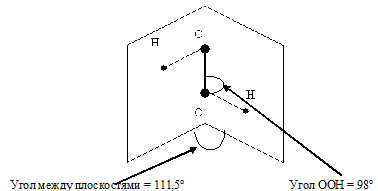
Степень окисления кислорода равна −I, валентность атома O равна 2. Группу −O−O− называют пероксогруппой. Энергия связи О-О (210 кДж/моль) почти в 2 раза меньше энергии связи О-Н (468 кДж/моль), длина связи О-О равна 0,145нм. Из-за несимметричного распределения связей Н — О молекула Н2О2 сильно полярна. Между молекулами Н2О2 возникает довольно прочная водородная связь, поэтому в обычных условиях Н2О2 — сиропообразная светло-голубая жидкость с высокой температурой кипения равной 150 °С. Температура плавления 0,41°С. Почти в 1.5 раза тяжелее воды, поверхностное натяжение ( ) больше, чем у Н2О.
Задача 800.
Написать уравнение реакции разложения пероксида водорода. К какому типу окислительно-восстановительных реакций она относится?
Решение:
Уравнение реакции разложения пероксида водорода имеет вид:
2Н2О2 ⇔ 2Н2О + О2.
Данная реакция относится к окислительно-восстановительным реакциям самоокисления-самовосстановления, потому что пероксид водорода в реакции разложения является и восстановителем, и окислителем одновременно. Степень окисления кислорода изменяется от -1 до -2 (восстановление) и от -1 до 0 (окисление), потому что кислород в пероксиде водорода находится в своей промежуточной степени окисления (-1).
Уравнения электронного баланса:
Ионно-молекулярная форма:
4О-= О20 + 2О2-
Задача 801.
К 150 г раствора Н2О2 прибавили немного диоксида марганца. Выделившийся кислород при нормальных условиях занял объем 10-3м3. Вычислить массовую долю Н2О2 в исходном растворе.
Решение:
Уравнение реакции имеет вид:
М(Н2О2) = 34г/моль; m(H2O2) = 34г.
Находим массу разложившегося пероксида водорода из пропорции:
х : 68 = 1 : 22,4;
х = (1,68)/22,4 = 3,04г.
Массовую долю пероксида водорода находим из уравнения:
где w% — массовая доля вещества В; m(B) — масса вещества В; m(р-ра) — масса раствора.
Отсюда
Ответ: 2,02%.
Источник
Пероксид водорода
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 26 января 2021; проверки требуют 2 правки.
Перокси́д водоро́да (пе́рекись водорóда), H2O2 — простейший представитель пероксидов. Бесцветная жидкость с «металлическим» вкусом, неограниченно растворимая в воде, спирте и эфире. Концентрированные водные растворы взрывоопасны. Пероксид водорода является хорошим растворителем. Из воды выделяется в виде неустойчивого кристаллогидрата H2O2∙2H2O.
Молекула пероксида водорода имеет следующее строение:
Структура молекулы пероксида водорода
Вследствие несимметричности молекула H2O2 сильно полярна (μ = 0,7⋅10−29 Кл·м). Относительно высокая вязкость жидкого пероксида водорода обусловлена развитой системой водородных связей. Поскольку атомы кислорода имеют неподелённые электронные пары, молекула H2O2 также способна образовывать донорно-акцепторные связи.
Химические свойства[править | править код]
Молекула пероксида водорода сильно полярна, что приводит к возникновению водородных связей между молекулами. Связь O-O непрочна, поэтому H2O2 — неустойчивое соединение, легко разлагается. Также этому может поспособствовать присутствие ионов переходных металлов. В разбавленных растворах пероксид водорода тоже неустойчив и самопроизвольно диспропорционирует на H2O и O2. Реакция диспропорционирования катализируется ионами переходных металлов, некоторыми белками:
В присутствии катализаторов разложения в среде кислорода может появляться озон:
Однако очень чистый пероксид водорода вполне устойчив.
Пероксид водорода проявляет слабые кислотные свойства (К = 1,4⋅10−12), и поэтому диссоциирует по двум ступеням:
При действии концентрированного раствора Н2O2 на некоторые гидроксиды в ряде случаев можно выделить пероксиды металлов, которые можно рассматривать как соли пероксида водорода (Li2O2, MgO2 и др.):
Пероксидная группа [-O-O-] входит в состав многих веществ. Такие вещества называют пероксидами, или пероксидными соединениями. К ним относятся пероксиды металлов (Na2O2, BaO2 и др.). Кислоты, содержащие пероксидную группу, называют пероксокислотами, например, пероксомонофосфорная H3PO5, пероксодисерная H2S2O8 и пероксоазотная HNO4 кислоты.
Окислительно-восстановительные свойства[править | править код]
Пероксид водорода обладает окислительными, а также восстановительными свойствами. Он окисляет нитриты в нитраты, выделяет иод из иодидов металлов, расщепляет ненасыщенные соединения по месту двойных связей. Пероксид водорода восстанавливает соли золота и серебра, а также марганец при реакции с водным раствором перманганата калия в кислой среде.
При восстановлении Н2O2 образуется Н2O или ОН-, например:
При действии сильных окислителей H2O2 проявляет восстановительные свойства, выделяя свободный кислород:
например:
Реакцию KMnO4 с Н2O2 используют в химическом анализе для определения содержания Н2O2:
Окисление органических соединений пероксидом водорода (например, сульфидов и тиолов) целесообразно проводить в среде уксусной кислоты.
Биологические свойства[править | править код]
Пероксид водорода относится к реактивным формам кислорода и при повышенном образовании в клетке вызывает оксидативный стресс. Некоторые ферменты, например глюкозоксидаза, образуют в ходе окислительно-восстановительной реакции пероксид водорода, который может играть защитную роль в качестве бактерицидного агента. В клетках млекопитающих нет ферментов, которые бы восстанавливали кислород до перекиси водорода. Однако несколько ферментных систем (ксантиноксидаза, НАДФ•H-оксидаза, циклооксигеназа и др.) продуцируют супероксид, который спонтанно или под действием супероксиддисмутазы превращается в пероксид водорода.
Получение[править | править код]
Исторически первым промышленным методом синтеза пероксида водорода был электролиз серной кислоты или раствора сульфата аммония в серной кислоте, в ходе которого образуется пероксодисерная кислота, с последующим гидролизом последней до пероксида и серной кислоты:
С середины XX века персульфатный процесс синтеза пероксида водорода был вытеснен антрахиноновым процессом, разработанным компанией BASF в 1930-х[2]. В этом процессе формально идет окисление водорода кислородом воздуха с катализом алкилпроизводными антрахинона:
Процесс основан на автоокислении алкилантрагидрохинонов (обычно 2-этил-, 2-трет-бутил- и 2-пентилантрагидрохинонов) кислородом воздуха с образованием антрахинонов и пероксида водорода. Реакция проводится в растворе алкилантрагидрохинонов в бензоле с добавлением вторичных спиртов, по завершении процесса пероксид водорода экстрагируют из органической фазы водой. Для регенерации исходных антрагидрохинонов бензольный раствор антрахинонов восстанавливают водородом в присутствии каталитических количеств палладия[3].
Пероксид водорода также может быть получен каталитическим окислением изопропилового спирта [4]:
при этом ценным побочным продуктом этой реакции является ацетон, однако в широких масштабах в промышленности этот метод в настоящее время не используется.
В лабораторных условиях для получения пероксида водорода используют реакцию разбавленной серной кислоты с пероксидом бария:
Концентрирование и очистку пероксида водорода проводят осторожной перегонкой.
В последнее время (кон. XX в.) удалось синтезировать H2O3 и H2O4. Эти соединения весьма неустойчивы. При обычных температурах (н.у.) они разлагаются за доли секунды, однако при низких температурах порядка −70 °C существуют часами. Спектро-химическое исследование показывает, что их молекулы имеют зигзагообразную цепную структуру (подобную сульфанам): H-O-O-O-H, H-O-O-O-O-H[5].
Применение[править | править код]
3 % раствор перекиси водорода
Благодаря своим сильным окислительным свойствам пероксид водорода нашёл широкое применение в быту и в промышленности, где используется, например, как отбеливатель на текстильном производстве и при изготовлении бумаги. Применяется как ракетное топливо, в качестве окислителя или как однокомпонентное (с разложением на катализаторе), в том числе для привода турбонасосных агрегатов.[6] Используется в аналитической химии, в качестве пенообразователя при производстве пористых материалов, в производстве дезинфицирующих и отбеливающих средств. В промышленности пероксид водорода также находит своё применение в качестве катализатора, гидрирующего агента, как эпоксидирующий агент при эпоксидировании олефинов.
Хотя разбавленные растворы перекиси водорода применяются для небольших поверхностных ран, исследования показали, что этот метод, обеспечивая антисептический эффект и очищение, также продлевает время заживления[7][8]. Обладая хорошими очищающими свойствами, пероксид водорода на самом деле не ускоряет заживление ран. Достаточно высокие концентрации, обеспечивающие антисептический эффект, могут также продлевать время заживления из-за повреждения прилегающих к ране клеток[9]. Более того, пероксид водорода может мешать заживлению и способствовать образованию рубцов из-за разрушения новообразующихся клеток кожи[10].
Однако в качестве средства для очистки глубоких ран сложного профиля, гнойных затёков, флегмон и других гнойных ран, санация которых затруднена, пероксид водорода остаётся предпочтительным препаратом, так как он обладает не только антисептическим эффектом, но и создаёт большое количество пены при взаимодействии с ферментом каталазой. Это в свою очередь позволяет размягчить и отделить от тканей некротизированные участки, сгустки крови, гноя, которые будут легко смыты последующим введением в полость раны антисептического раствора. Без предварительной обработки пероксидом водорода антисептический раствор не сможет удалить эти патологические образования, что приведет к значительному увеличению времени заживления раны и ухудшит состояние больного.
Перекись водорода применяют для растворения пробок в слуховых каналах. Раствор вступает в реакцию с ушной серой и растворяет пробку.
Пероксид водорода применяется также для обесцвечивания волос[11].
В пищевой промышленности растворы пероксида водорода применяются для дезинфекции технологических поверхностей оборудования, непосредственно соприкасающихся с продукцией. Кроме того, на предприятиях по производству молочной продукции и соков, растворы перекиси водорода используются для дезинфекции упаковки (технология «Тетра Пак»). Для технических целей пероксид водорода применяют в производстве электронной техники.
В быту применяется также для выведения пятен MnO2, образовавшихся при взаимодействии перманганата калия («марганцовки») с предметами (ввиду его восстановительных свойств).
3%-ный раствор пероксида водорода используется в аквариумистике для оживления задохнувшейся рыбы, а также для очистки аквариумов и борьбы с нежелательной флорой и фауной в аквариуме[12].
Перекись водорода используется в известном опыте, демонстрирующем многократное увеличение объёма вещества в результате химической реакции[13].
Формы выпуска[править | править код]
Выпускается в виде водных растворов, стандартная концентрация 1-6 %, 30, 38, 50, 60, 85, 90 и 98 %[источник не указан 620 дней]. 30 % водный раствор пероксида водорода, стабилизированный добавлением фосфатов натрия, называется пергидролем. Выпускаемый в виде таблеток твёрдого клатрата с мочевиной пероксид водорода называется гидроперитом.
Опасность применения[править | править код]
Кожа после попадания на неё концентрированного раствора перекиси водорода.
Несмотря на то, что пероксид водорода — нетоксичен, его концентрированные растворы при попадании на кожу, слизистые оболочки и в дыхательные пути вызывают ожоги. В больших концентрациях недостаточно чистый пероксид водорода может быть взрывоопасен. Опасен при приёме внутрь концентрированных растворов. Вызывает выраженные деструктивные изменения, сходные с действиями щелочей. Летальная доза 30%-го раствора пероксида водорода (пергидроля) — 50-100 мл[14].
Примечания[править | править код]
- ↑ 1 2 https://www.cdc.gov/niosh/npg/npgd0335.html
- ↑ H. Riedl and G. Pfleiderer, U.S. Patent 2,158,525 (2 October 1936 in USA, and 10 October 1935 in Germany) to I. G. Farbenindustrie, Germany
- ↑ Jose M. Campos-Martin, Gema Blanco-Brieva, Jose L. G. Fierro; Blanco-Brieva; Fierro. Hydrogen Peroxide Synthesis: An Outlook beyond the Anthraquinone Process (англ.) // Angewandte Chemie International Edition : journal. — 2006. — Vol. 45, no. 42. — P. 6962-6984. — doi:10.1002/anie.200503779. — PMID 17039551.
- ↑ Burgess, A. R.; Cullis, C. F.; Newitt, E. J. 365. The gaseous oxidation of isopropyl alcohol. Part 1. The influence of temperature, pressure, and mixture composition on the formation of hydrogen peroxide and other products (англ.) // Journal of the Chemical Society (англ.)русск. : journal. — Chemical Society, 1961. — 1 January (no. 0). — P. 1884-1893. — ISSN 0368-1769. — doi:10.1039/JR9610001884.
- ↑ Ахметов Н. С. Общая и неорганическая химия. — 2-е изд. — М.:Высшая школа, 1988. — с. 304.
- ↑ Космонавтика, энциклопедия. М., 1985.
- ↑ O’Connor, Anahd. Really? The Claim: Hydrogen Peroxide Is a Good Treatment for Small Wounds, New York s (19 июня 2007). Дата обращения 13 июля 2011.
- ↑ Carroll, Aaron E., Rachel C. Vreeman. Medical myths don’t die easily, CNN (12 июля 2011). Дата обращения 13 июля 2011.
- ↑ Joseph M. Ascenzi, Handbook of Disinfectant and Antiseptics, CRC Press, 1996, ISBN 0824795245, page 161.
- ↑ Wilgus T. A., Bergdall V. K., Dipietro L. A., Oberyszyn T. M. Hydrogen peroxide disrupts scarless fetal wound repair (неопр.) // Wound Repair Regen. — 2005. — Т. 13, № 5. — С. 513-519. — doi:10.1111/j.1067-1927.2005.00072.x. — PMID 16176460.
- ↑ Средства для осветления волос
- ↑ М. Бейли, П. Бергресс. Золотая книга аквариумиста. Полный справочник по уходу за пресноводными тропическими рыбами. — М.: Аквариум ЛТД, 2004.
- ↑ Elephant’s Toothpaste. University of Utah Chemistry Demonstrations. University of Utah. Дата обращения: 21 марта 2014.
- ↑ Противопоказания к применению перекиси водорода в лечебных целях Архивная копия от 25 августа 2011 на Wayback Machine[неавторитетный источник?]
Литература[править | править код]
- Ахметов Н. С. Общая и неорганическая химия. — М.: Высшая школа, 2001.
- Карапетьянц М. Х., Дракин С. И. Общая и неорганическая химия. — М.: Химия, 1994.
Ссылки[править | править код]
- NIST Chemistry WebBook
Источник
Загадочный пероксид водорода. 1. Н2О2 — вездесущий двуликий Янус
Вы хотите познавать химию и профессионально, и с удовольствием? Тогда вам сюда! Автор методики системно-аналитического изучения химии Богунова В.Г. раскрывает тайны решения задач, делится секретами мастерства при подготовке к ОГЭ, ЕГЭ, ДВИ и олимпиадам
Ничто не красит женщину так, как перекись водорода (Народная мудрость)
Мальчики и девочки, папы и мамы, бабушки и дедушки, химички и химичи, составители и эксперты ЕГЭ (особенно!) читайте внимательно серию статей об участии пероксида водорода в ОВР. Иначе, на ЕГЭ может случиться конфуз, когда вы не сможете написать реакции в 30-м и 32-м заданиях, не решится 34-я задача, будут непонятны многие реакции в тестовых заданиях типа 8, 9, 10, 14, 17, 21.
Химический портрет пероксида водорода
Пероксид водорода H2O2 — химическое соединение водорода с кислородом. Структурная формула Н-О-О-Н показывает, что два атома кислорода непосредственно соединены друг с другом. Связь это непрочна и обусловливает неустойчивость молекулы. Чистый пероксид водорода разлагается (со взрывом) на воду и кислород. В разбавленных водных растворах пероксид водорода более устойчив.
► Впервые пероксид водорода получил в 1818 г. французский химик Л.Ж. Тенар, действуя охлажденной соляной кислотой на пероксид бария
BaO2 + 2HCl → BaCl2 + H2O2
Пероксид бария получали сжиганием металлического бария. Для выделения из раствора Н2О2 Тенар удалил из него образовавшийся хлорид бария
BaCl2 + Ag2SO4 → 2AgCl↓ + BaSO4↓
Чтобы не использовать дорогую соль серебра в последующем для получения Н2О2 использовали серную кислоту, поскольку при этом сульфат бария остается в осадке, поскольку карбонат бария также нерастворим
BaO2 + H2SO4 → BaSO4↓ + H2O2
Атом кислорода в пероксиде водорода имеет степень окисления (-1), поэтому в окислительно-восстановительных реакциях пероксид может выполнять функцию как окислителя, так и восстановителя
► Пероксид водорода — сильный окислитель, легко отдает атом кислорода. При действии безводной и концентрированной Н2О2 на бумагу, опилки и другие горючие вещества они воспламеняются.
Обратите внимание! Если пероксид — окислитель, то продуктом восстановления кислорода будет вода (Н2О). На шкале степеней окисления окислитель «падает вниз»
► H2O2 обладает свойствами слабого восстановителя.
Обратите внимание! Если пероксид — восстановитель, то продуктом его окисления будет свободный кислород (О2). На шкале степеней окисления восстановитель «поднимается вверх»
В следующих статьях вас ожидает много ОВР с пероксидом водорода. Это будут не только классические, но и нестандартные, очень сложные реакции, вызывающие дрожь даже у мудрых экспертов ЕГЭ. Я проведу анализ каждой реакции и обязательно научу вас писать все уравнения ОВР. Со мной не пропадете! Если будете внимательно читать статьи, работать над заданиями и выполнять все рекомендации — высокий балл на ЕГЭ будет вам заслуженной наградой!
Вы не умеете писать ОВР методом полуреакций?! Спокойствие, только спокойствие! Самый лучший в мире репетитор в полном расцвете сил поможет вам! Заходите ко мне на сайт, посетите страницу «Окислительно-восстановительные реакции». И будет вам счастье!
А пока — пока! Успехов и удачи! До встречи на полях Яндекс Дзен! Не забывайте подписаться на канал и поставить лайк!
Вы хотите сдавать ЕГЭ по химии и биологии? Обязательно посетите мой сайт Репетитор по химии и биологии. Здесь вы найдете огромное количество задач, заданий, теоретического материала и познакомитесь с моими учениками.
На странице ВК я анонсирую свои публикации, вебинары, уроки, рассказываю и показываю решение задач и заданий, выкладываю новинки теоретического материала, конспекты и лекции. Добавляйтесь ко мне в друзья, и вы всегда будете в курсе всех событий, связанных с подготовкой к ЕГЭ, ДВИ, олимпиадам!
Полный каталог статей репетитора Богуновой В.Г. вы найдете на странице сайта Статьи репетитора
Подписывайтесь на YouTube-канал Репетитор по химии и биологии. Здесь ежедневно появляются новые вебинары, видео-уроки, видео-консультации, видео-решения.
Пишите мне в WhatsApp +7(903)186-74-55, я отвечу вам обязательно.
Репетитор по химии и биологии кбн В.Богунова
Источник