Можно ли получить метан используя синтез газ
Содержание статьи
Метан: способы получения и свойства | CHEMEGE.RU
Метан CH4 – это предельный углеводород, содержащий один атом углерода в углеродной цепи. Бесцветный газ без вкуса и запаха, легче воды, нерастворим в воде и не смешивается с ней.
Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом.
Самый первый представитель гомологического ряда алканов – метан CH4, или Н–СH2–H.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
| Название алкана | Формула алкана |
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4h20 |
| Пентан | C5h22 |
| Гексан | C6h24 |
| Гептан | C7h26 |
| Октан | C8h28 |
| Нонан | C9H20 |
| Декан | C10H22 |
Общая формула гомологического ряда алканов CnH2n+2.
Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества.
В молекуле метана встречаются связи C–H. Связь C–H ковалентная слабополярная. Это одинарная σ-связь. Атом углерода в метане образует четыре σ-связи. Следовательно, гибридизация атома углерода в молекуле метана– sp3:
При образовании связи С–H происходит перекрывание sp3-гибридной орбитали атома углерода и s-орбитали атома водорода:
Четыре sp3-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109о 28′ друг к другу:

Это соответствует тетраэдрическому строению молекулы.
Например, в молекуле метана CH4 атомы водорода располагаются в пространстве в вершинах тетраэдра, центром которого является атом углерода

Для метана не характерно наличие изомеров – ни структурных (изомерия углеродного скелета, положения заместителей), ни пространственных.
Метан – предельный углеводород, поэтому он не может вступать в реакции присоединения.
Для метана характерны реакции:
- разложения,
- замещения,
- окисления.
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для метана характерны только радикальные реакции.
Метан устойчив к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагирует с концентрированными кислотами, щелочами, бромной водой.
1. Реакции замещения
Для метана характерны реакции радикального замещение.
1.1. Галогенирование
Метан реагирует с хлором и бромом на свету или при нагревании.
При хлорировании метана сначала образуется хлорметан:
Хлорметан может взаимодействовать с хлором и дальше с образованием дихлорметана, трихлорметана и тетрахлорметана:
Химическая активность хлора выше, чем активность брома, поэтому хлорирование протекает быстро и неизбирательно.
Бромирование протекает более медленно.
Реакции замещения в алканах протекают по свободнорадикальному механизму.
Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат неспаренный электрон.
Первая стадия. Инициирование цепи.
Под действием кванта света или при нагревании молекула галогена разрывается на два радикала:
Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом.
Вторая стадия. Развитие цепи.
Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород.
При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с новой нераспавшейся молекулой хлора:
Третья стадия. Обрыв цепи.
При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами, образуя молекулы, радикальный процесс обрывается.
Могут столкнуться как одинаковые, так и разные радикалы, в том числе два метильных радикала:
1.2. Нитрование метана
Метан взаимодействует с разбавленной азотной кислотой по радикальному механизму, при нагревании до 140оС и под давлением. Атом водорода в метане замещается на нитрогруппу NO2.
CH4 + HNO3 = CH3NO2 + H2O
2. Реакции разложения метана (дегидрирование, пиролиз)
При медленном и длительном нагревании до 1500оС метан разлагается до простых веществ:
Если процесс нагревания метана проводить очень быстро (примерно 0,01 с), то происходит межмолекулярное дегидрирование и образуется ацетилен:
Пиролиз метана – промышленный способ получения ацетилена.
3. Окисление метана
Алканы – малополярные соединения, поэтому при обычных условиях они не окисляются даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.).
3.1. Полное окисление – горение
Алканы горят с образованием углекислого газа и воды. Реакция горения алканов сопровождается выделением большого количества теплоты.
CH4 + 2O2 → CO2 + 2H2O + Q
Уравнение сгорания алканов в общем виде:
CnH2n+2 + (3n+1)/2O2 → nCO2 + (n+1)H2O + Q
При горении алканов в недостатке кислорода может образоваться угарный газ СО или сажа С.
Промышленное значение имеет реакция окисления метана кислородом до простого вещества – углерода:
CH4 + O2 → C + 2H2O
Эта реакция используется для получения сажи.
3.2. Каталитическое окисление
- При каталитическом окислении метана кислородом возможно образование различных продуктов в зависимости от условий проведения процесса и катализатора. Возможно образование метанола, муравьиного альдегида или муравьиной кислоты:

- Важное значение в промышленности имеет паровая конверсия метана: окисление метана водяным паром при высокой температуре.
Продукт реакции – так называемый «синтез-газ».
1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)
Это один из лабораторных способов получения алканов. При этом происходит удвоение углеродного скелета. Реакция больше подходит для получения симметричных алканов. Получить таким образом метан нельзя.
2. Водный или кислотный гидролиз карбида алюминия
Al4C3 + 12H2O = 4Al(OH)3 + 3CH4
Al4C3 + 12HCl = 4AlCl3 + 3CH4
Этот способ получения используется в лаборатории для получения метана.
3. Декарбоксилирование солей карбоновых кислот (реакция Дюма)
Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении.
R–COONa + NaOH → R–H + Na2CO3
Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты.
При взаимодействии ацетата натрия с гидроксидом натрия при сплавлении образуется метан и карбонат натрия:
4. Синтез Фишера-Тропша
Из синтез-газа (смесь угарного газа и водорода) при определенных условиях (катализатор, температура и давление) можно получить различные углеводороды:
nCO + (3n+1)H2 = CnH2n+2 + nH2O
Это промышленный процесс получения алканов.
Синтезом Фишера-Тропша можно получить метан:
CO + 4H2 = CH4 + 2H2O
5. Получение метана в промышленности
В промышленности метан получают из нефти, каменного угля, природного и попутного газа. При переработке нефти используют ректификацию, крекинг и другие способы.
Источник
Cинтез-газ: способы получения и применение
Определение
Понятие «синтез-газ» применяют к разным смесям монооксида углерода (СО) и водорода (Н2), которые используются для получения некоторых нефтехимических продуктов. Его в основном получают из природного газа (метана). Действительно, важнейшие вещества — аммиак, метанол и парафиновые углеводороды — получают именно из синтез-газа.
Получение
Существуют два основных метода получения синтез-газа – конверсия метана с водяным паром и парциальное (частичное) окисление. Оба метода довольно просты.
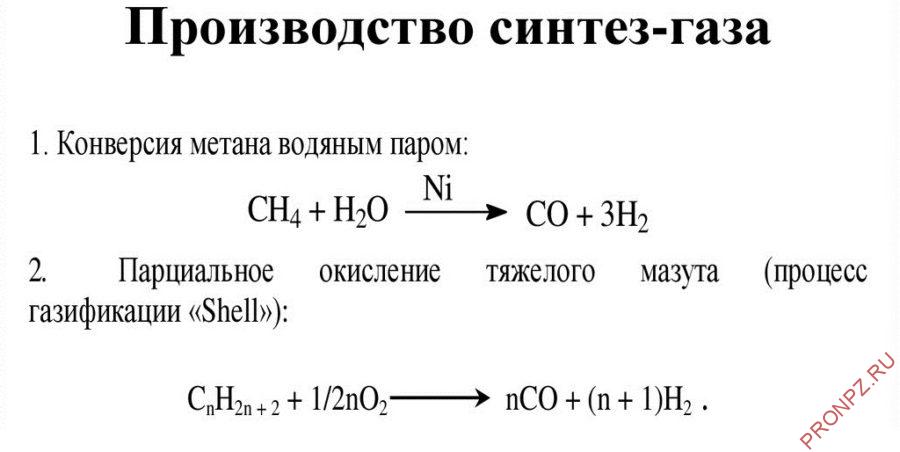
Конверсия метана с паром
Конверсия с паром состоит в пропускании метана или нафты и водяного пара над никелевым катализатором. Реакция протекает за счет разрушительной силы высоких температур и давлений, и ее следует проводить в реакторах, аналогичных печам крекинга. При этом происходят побочные процессы, при водящие к образованию СО2 и углерода. Углерод откладывается на катализаторе и дезактивирует его.
Парциальное окисление метана
Другой метод — это парциальное (частичное) окисление метана. Процесс проводят при высоких температурах без катализатора. Метод парциального окисления обычно используют для превращения более тяжелых видов сырья — от нафты до остаточного топлива — в тех случаях, когда в распоряжении нет природного газа и легких углеводородов (этана, пропана и бутана). В обоих процессах выход суммы СО и Н2 составляет 90 – 95%.
В качестве побочного продукта получают СО2, который можно удалить либо экстракцией растворителем, либо можно ввести в реакцию с водяным паром дополнительное количество метана, что даст СО и Н2. Эта реакция протекает при высоких температурах и давлениях и в присутствии никелевого катализатора.
Транспортировка
Обычно установка по производству синтез-газа бывает интегрирована в структуру завода, на котором он перерабатывается.
Единственным приемлемым способом транспортировки синтез-газа является его транспортировка по трубопроводам.
Применение
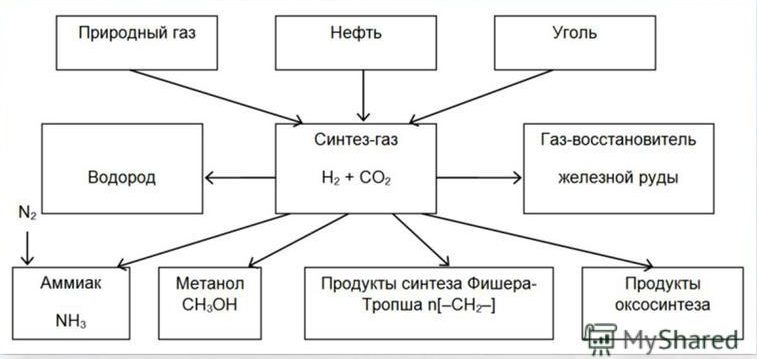 Получение и применение синтез-газа
Получение и применение синтез-газа
Получение аммиака
Наиболее важной областью применения синтез-газа является производство аммиака – NH3.
Смесь азота и водорода пропускают над железным катализатором (который содержит оксид алюминия в качестве промотора). Реакция проходит в очень жестких условиях — при температуре 420 С и давлении 280 атм.
Большая часть установок по производству аммиака снабжена оборудованием для отделения СО от сырья, так как СО может отравлять катализатор. Чаще всего с этой целью СО обрабатывают водяным паром для получения СО и Н2. Диоксид углерода удаляют экстракцией этаноламином, а Н2 направляют на рециркуляцию.
Получение метанола
Метанол часто называют древесным спиртом. Это связано с тем, что первым промышленным способом получения метанола была сухая перегонка свежеспиленной древесины лиственных деревьев. Помимо других соединений в летучей фракции присутствует метанол. Отсюда и произошло название «древесный спирт».
С 1923 г. метанол производится в промышленности из синтез-газа; в настоящее время большую часть метанола получают именно таким методом. По нескольким причинам эти установки обычно строят вблизи установок для производства аммиака или даже объединяют с ними.
Технология и оборудование аналогичны, и в производстве метанола можно использовать СО2, образующийся при синтезе аммиака. В этом случае СО2 вводят в реакцию с метаном и водяным паром над никелевым катализатором, приводящую к образованию дополнительного количества СО и Н2, которые затем взаимодействуют, давая метанол.
Процесс проводят при давлении 67 – 100 атм. И температуре 200 – 260оС на катализаторах на основе оксидов меди и цинка.
Синтез Фишера-Тропша
Каталитическое гидрирование оксида углерода (синтез Фишера-Тропша) для получения углеводородов, в частности парафинов, в основном нормального строения и олефинов, является гетерогенной реакцией. Проводится она преимущественно над кобальтовыми или над железными катализаторами с использованием возможно более чистых смесей оксида углерода и водорода. Оптимальные рабочие температуры синтеза различны для различных катализаторов.
Никелевые и кобальтовые катализаторы дают оптимальные результаты при 170-205, железные — при 200-325°С. Синтез на никелевых катализаторах ведется практически только при нормальном давлении, так как при повышенном давлении резко усиливается образование карбонилов.
На железном и кобальтовом катализаторах можно работать без образования карбонилов при давлениях до 20 атм.
Считается, что при синтезе по Фишеру-Тропшу на железных катализаторах оксид углерода гидрируется с образование метиленовой группа, которая затем полимеризуется. Оксид углерода конвертируется в углекислоту. При этом кислород оксида углерода связывается, образуя воду. Этим реакциям благоприятствуют более высокая температура синтеза на железных катализаторах и активность железа по отношению к реакции конверсии.
С технической точки зрения решающее значение при синтезе Фишера-Тропша имеют, во-первых, очень большая теплота реакции каталитического гидрирования оксида углерода и, во-вторых, необходимость очень точного соблюдения постоянной температуры синтеза. В противном случае значительно возрастает нежелательное образование метана. Кроме того, при высоких температурах наблюдается отложение углерода на катализаторе, приводящее к быстрой его дезактивации.
Источник
Си-газ — как альтернативный вид энергии завоёвывает мировой рынок.
Син-газ — для кого-то новое и в тоже время давно известное слово. В этой публикации коротко разберём что это…
Из синтез-газа получают сырье в химической промышленности. Также синтез-газ применяют как основной элемент для получения метилового спирта и жидкого синтетического топлива. Синтез-газ можно широко применять как источник тепла, которое в больших количествах выделяется при сжигании синтез-газа.
Источник фото: linkewire.com
Историческая справка
История человечества знает довольно много примеров, когда в силу необходимости рождались кардинально новые подходы к решению существующих жизненно важных проблем.
Первым известным человечеству способом получения синтез-газа была газификация каменного угля в Англии еще в 30-е годы XIX века.
в Германии в промежуток между первой и второй мировыми войнами, лишенной доступа к крупным нефтяным источникам, возник серьезный дефицит топлива, которое было необходимо для функционирования гражданской и военной техники.
Располагая существенными запасами ископаемого угля, Германия начала искать пути его преобразования в жидкое топливо, пригодное для двигателей внутреннего сгорания. Эта проблему удалось решить благодаря усилиям превосходных химиков Ф. Фишера и Х. Тропша.
«Cинтез-газ» в основном получают из природного газа (метана). Из синтез-газа получают важнейшие вещества — аммиак, метанол и парафиновые углеводороды.
Существуют три основных метода получения синтез-газа:
Газификация угля. Данный процесс основан на взаимодействии каменного угля с водяным паром, благодаря которому протекает реакция сгорания угля, которая обеспечивает необходимый тепловой баланс.
Конверсия метана с паром. Конверсия метана с паром заключается в пропускании метана и водяного пара над никелевым катализатором. Реакция протекает с помощью высоких температур и давлений 800-900 градусов.
Парциальное окисление метана. Процесс проводят при высоких температурах более 1300 градусов. Данный способ применим к любому сырью, содержащему углеводороды но наиболее часто используется высококипящая фракция нефти — мазут.
Преимущества син-газа:
⦁ Наличие запасов сырья для син-газа при отсутствии углеводородного сырья.
⦁ Широкий спектр применения.
⦁ Синтетическое жидкое топливо из синтез-газа не уступает по качеству традиционному.
⦁ Син-газ экологически чистый продукт.
⦁ Побочные продукты, углекислый газ и сера, удаляются путем очистки селективными растворителями.
⦁ Возможность добычи син-газа при утилизации бытовых отходов.
⦁ Возможность получения син-газа методом подземной газификации, непосредственно в пласте угля.
Недостатки син-газа:
⦁ Повышенная инвестиционная затратность в связи со сложностью технологии.
⦁ Повышенная экологическая опасность производства синтетического жидкого топлива.
⦁ Высокое потребление воды: 5-7 единиц на единицу полученного топлива при производстве синтетического топлива.
⦁ При получении син-газа получаемый углерод откладывается на катализаторе и дезактивирует его.
⦁ В качестве побочного продукта получают СО2.
⦁ Единственным приемлемым способом транспортировки синтез-газа является его транспортировка по трубопроводам.
Методика газификации каменного угля была вытеснена методами, основанными на использовании нефти и природного газа. Газификации каменного угля развивается с переменным успехом, при падении цен на нефть и природный газ затухает, при росте цен на УВС возрастает.
В настоящее время в мире суммарная мощность производств угля в жидкие топлива составляет 15 ГВтт. Самые крупные заводы по получению СЖТ расположены в ЮАР, там перерабатывается доступный недорогой уголь.
Источник фото: КНР — Завод Yitai ICL.
Самая амбициозная программа была запущена в Китае: до 2030 года планируется вложить 130 млрд. долл. США на развитие таких проектов. Планируется, что через 10 лет мощность заводов СЖТ в Китае будет доведена до 1,2 млн бар/сут.
В России газификация является одним из самых экологичных способов переработки нефтяных остатков, таких как мазут и пр., обеспечивающих получение ценных продуктов — электроэнергии, водорода, синтетических топлив, сырья для нефтехимии.
Источник
Метан из биомассы
Хорошо забытые технологии будущего
До настоящего времени в мире имеется лишь несколько реализованных проектов введенных в эксплуатацию установок получения метана из древесины. Первые результаты позволяют надеяться на серьезный прорыв в этом направлении.
Формулы к статье «Метан из биомассы» смотрите в PDF-версии журнала
Метан CH4 − газ без цвета и запаха, который почти в два раза легче воздуха. Он образуется в природе в результате разложения без доступа воздуха остатков растительных и животных организмов. Поэтому он присутствует, например, в заболоченных водоемах и каменноугольных шахтах. В значительных количествах метан содержится в природном газе, который широко используется сейчас в качестве топлива в быту и на производстве.
Одна из самых быстро развивающихся сегодня технологий в области производства энергии из возобновляемых источников − это производство биометана анаэробной ферментации с последующей подачей его в сети, по которым потребителям доставляется природный газ. Вопреки высоким издержкам на производство биометана по такой технологии (8–10 евроцентов на 1 кВт•ч), число установок для его выработки непрерывно растет. В 2009 году на территории ФРГ находились в эксплуатации уже 23 классические (работающие на навозе) биогазовые установки с подачей газа в действующие газопроводы природного газа, еще 36 находятся в стадии строительства или планирования. Причной роста этого показателя является Закон о возобновляемой энергии (Erneuerbare Energien Gesetz − EEG), принятый в ФРГ в 2004 году, дополненный в 2009 году и позволяющий продавцам газа предлагать своим клиентам газ, полученный из регенеративных источников, и получать государственные субсидии на выработку электроэнергии из возобновляемых источников энергии (ВИЭ).

Первый в мире завод по производству газа SNG из древесины в
австрийском г. Гюссинг. На переднем плане узел получения метана
Биометан по классической и применяемой сейчас повсеместно схеме получают из растительных субстратов (например, кукурузы), навозной жижи свиных комплексов, навоза крупного рогатого скота, куриного помета и т. п. Такой метан из биомассы может быть получен путем ее анаэробного перегнивания (ферментации). При анаэробном перегнивании органические вещества (естественные отходы) разлагаются в отсутствие кислорода. Этот процесс протекает в три стадии с участием двух различных групп бактерий. На первой стадии сложные органические соединения (жирные кислоты, протеины, углеводы) в результате ферментационного гидролиза превращаются в более простые соединения. На второй стадии простые соединения подвергаются воздействию группы анаэробных (или кислотообразующих) бактерий, что приводит к образованию главным образом летучих жирных кислот. На третьей стадии органические кислоты под действием строго анаэробных (или метанообразующих) бактерий превращаются в диоксид углерода и метан. После этой стадии получается обогащенный метаном газ (биогаз), теплота сгорания которого 5340–6230 кКал/м3.
«Эрзацгаз» из твердой биомассы, такой как древесина, имеет существенное преимущество перед биогазом, полученным из навоза, помета: в распоряжении тех, кто занимается производством такого газа, внушительные объемы отходов лесопиления, лесозаготовок и деревообработки. Кроме того, на европейском рынке цены на отходы лесопиления и деревообработки в отличие от цен на сельскохозяйственные продукты, которые применяются для получения биогаза, колеблются гораздо меньше. Нельзя забывать и о том, что использование сельхозпродукции (зерна, кукурузы, рапса и т. п.) для получения биогаза ведет в конечном итоге к повышению цен на продуктовых рынках. Кроме того, отходящее в результате химической реакции тепло имеет более высокую температуру по сравнению с температурой отходящего тепла реакций ферментации в классических биогазовых установках. Отсюда следует, что тепловую энергию, высвобождающуюся при процессах метанирования древесины, можно с большей эффективностью использовать в региональном теплоснабжении. Немаловажно и то, что, в отличие от классических биогазовых установок, при работе установок для получения метана из древесины отсутствуют неприятные запахи. Кроме того, эти установки занимают намного меньше места, чем классические, и могут располагаться в черте городских агломератов.
Технологии

Склад топливной щепы
Результатом распространенного сегодня производства биометана из сельскохозяйственных субстратов способом брожения (анаэробной ферментации) является биометан, который преимущественно состоит из метана и двуокиси углерода. Затем биометан должен проходить специальную подготовку и доводку до качества природного газа путем отделения CO2. Потери тепла при ферментации лимитируют степень эффективности всей цепи процесса. КПД составляет 50–60%.
При производстве синтетического природного газа (Substitute Natural Gas − SNG) из углеродосодержащего твердого топлива, такого как уголь или биомасса (древесина), после тепловой газификации в первой стадии процесса получается так называемый синтетический газ, из которого после очистки от всевозможных примесей (в основном от двуокиси углерода и соединений серы и хлора) синтезируется метан. Этот экзотермический процесс происходит при температуре от 300 до 450 °C и давлении 1−5 бар в присутствии подходящего катализатора. При этом протекают следующие реакции:
Формулы смотрите в PDF-версии журнала
В противоположность анаэробной ферментации при термической газификации биомассы достигается более высокий КПД, вследствие того что отходящее тепло при производстве SNG может всегда использоваться на месте.
В принципе получение метана из синтез-газа, а также из газовых смесей водорода (H2) и окиси углерода (СО) − очень старая технология. Французский химик Поль Сабатье изобрел способ получения метана, названный его именем: реакция Сабатье или процесс Сабатье (фр. Sabatier-Reaktion). В 1912 году он получил за это Нобелевскую премию в области химии. Этот процесс представляет собой реакцию водорода с диоксидом углерода при повышенной температуре и давлении в присутствии никелевого катализатора для производства метана. В качестве более эффективного катализатора может применяться рутений с оксидом алюминия.
Процесс описывается следующей химической реакцией:
CO2 + 4H2 → CH4 + 2H2O.
Так как обе реакции сильно экзотермические, без принятия особых мер для охлаждения реакторов или рециркуляции при нагреве до 600 °C происходило бы разрушение катализатора. Кроме того, при высокой температуре сдвигается термодинамическое равновесие H2 и CO, так что достаточно высокого выхода метана можно достичь только при температуре ниже 300 °C.
Технология газификации была создана еще в 1800-е годы для производства синтетического газа, необходимого для освещения городов, а также используемого в качестве теплоносителя для бытовых и промышленных целей (металлургия, паровые машины и др.). Газификации подвергались как уголь, так и биомасса растений и продукты ее переработки (древесный уголь).
Использовать базовый процесс газификации угля для производства синтетических химических веществ и топлива начали с 1920-х годов в Институте Кайзера Вильгельма при исследовании угля в г. Мюльгейм-на-Руре (Германия). В этом институте Францем Фишером и Гансом Тропшом был изобретен способ получения синтез-газа (сингаза) для производства в Германии жидкого топлива из угля. Процесс Фишера − Тропша, или синтез Фишера − Тропша (СФТ), − это химическая реакция, протекающая в присутствии катализатора (железа, кобальта), при которой смесь монооксида углерода (CO) и водорода (H2), то есть синтез-газ, преобразуется в различные жидкие углеводороды. Получаемые углеводороды очищают для получения целевого продукта − синтетической нефти. Углекислый газ и монооксид углерода образуются при частичном окислении угля или (и) древесного топлива.
Процесс Фишера − Тропша описывается следующим химическим уравнением:
CO + 2H2 → —CH2— + H2O
2CO + H2 → —CH2— + CO2.
Полученный после газификации угля или твердых углеродосодержащих отходов сингаз может быть напрямую использован в качестве топлива, без дальнейшего преобразования по процессу Фишера − Тропша. Таким образом, довольно легко совершить переход от газового топлива к жидкому. Во время Второй мировой войны в Германии синтез Фишера − Тропша был использован на восьми заводах для производства синтетического дизельного топлива (около 600 тыс. т в год). Проект полностью финансировался государством. После окончания Второй мировой войны в Германии все эти заводы были закрыты и частично вместе с технологией вывезены в счет репараций в США, а оттуда разошлись по всему миру. В то же время в Южно-Африканской Республике компания South African Synthetic Oil Ltd. (SASOL), используя немецкую технологию, приступила к получению синтетического топлива и по сегодняшний день на своих четырех заводах в ЮАР и на одном заводе в Катаре производит более 200 тыс. баррелей нефтяного эквивалента жидких углеводородов в год. ЮАР долгое время была единственной страной в мире, где велись разработки процесса СФТ. Но после кризиса 1973 года мировые нефтяные и энергетические компании многих стран (особенно США и Германии) начали проявлять интерес как к производству синтетического жидкого топлива, так и к получению природного синтез-газа.
Разрабатывался целый ряд проектов получения природного синтез-газа, но только один из них успешно реализован в промышленном масштабе. В 1984 году в США был запущен завод по метанированию бурого угля Great Plains Synfuels Plant (Dakotagas Company), который до сегодняшнего дня производит синтетический природный газ, подаваемый в сеть, по которой транспортируется природный газ. Суточная производительность завода − 3,9 млн м3 SNG.
Уместно вспомнить и опыт Советского Союза, где с конца 1920-х до 1950-х годов работали газогенераторные установки, использующие древесину (дрова и древесный уголь) и торф с целью получения газообразного моторного топлива. В 1929 году в СССР была построена первая крупная газогенераторная станция, работающая на торфе, а в последующие годы − ряд других таких же станций на крупных предприятиях. Для транспортного топлива в основном применялась газогенерация древесины. После начала освоения Западной Сибири и открытия крупнейших в мире месторождений голубого топлива газогенерацию в СССР, к сожалению, незаслуженно забыли.
Получение метана из древесины
При газификации биомасса с химической формулой CHnOm преобразуется сначала в синтез-газ, состоящий из водорода и окиси углерода. Из стехиометрического общего уравнения реакции метанирования биомассы с формулой сумм
Ch2,23O0,38 + 0,5025 H2O→ 0,55875 CH4 +0,44125 C2O
следует, что вода или водяной пар должны подводиться в метан-реактор, а двуокись углерода выводиться из него. Здесь существует несколько вариантов: либо СО2, как в промышленном синтезе, удаляется из синтез-газа прямо из метан-реактора, либо, как и при подготовке биогаза (ферментации), после процесса метанирования, уже из нерафинированного синтетического природного газа. Преимущество первого способа перед остальными заключается в том, что на вход цикла метанирования поступает уже очищенный газ. Достоинства второго способа в том, что метан-реактор может работать с избытком водяного пара, что существенно уменьшает образование углерода.
Работы в этих направлениях ведутся в институте Пауля Шеррера (Швейцария), который, в частности, принимал участие в написании Программы получения метана из биомассы по новым технологиям (в каталитически активных вихревых слоях) в рамках проекта ЕС BioSNG. Эта технология была применена на практике на ТЭЦ австрийского г. Гюссинг (Gussing). Установка для синтеза метана, которая сдана в эксплуатацию в 2009 году, имеет мощность 1 мВт и работает на щепе. В настоящее время обсуждается реализация проекта по получению метана из древесины мощностью 30 МВт в шведском Гетеборге. Подобные работы ведутся в Германии (Штутгарт, фирма ZSW), Нидерландах (Центр исследований в энергетике, ECN) и в институте теплотехники Технического университета в г. Грац (Австрия) в сотрудничестве с фирмой Agnion в г. Пфаффенхофен-на-Ильме (ФРГ).
Эффективность синтеза метана из биомассы
При получении метана в каждой фазе процесса, как и в любом синтез-процессе, неизбежны потери. При протекании экзотермических реакций происходит отвод тепла, энергетическое содержание которого не может находиться в готовом продукте синтеза больше,чем химически связанная энергия при процессе синтеза. Для метанирования это значит, что только примерно 60% энергии используемой биомассы сохраняется в готовой продукции − SNG.
Но поскольку отводимое тепло имеет высокую температуру − от 200 до 400 °C, его можно использовать на месте. По этой причине небольшие установки синтеза метана становятся особенно доходными, так как можно решить вопрос использования отводимого тепла на 100%, например для отопления частных домовладений, фермерских хозяйств, применения в сушильных комплексах и т. п. Можно использовать не только отходящее тепло процессов газификации и метанирования, но и тепло конденсации водяного пара в нерафинированном сингазе, в составе которого содержится до 50% водяного пара. Общий КПД при таком полном использовании тепла и продажах полученного SNG в газовую сеть и газохранилища приближается к 95%. Окупаемость подобных проектов составляет всего несколько лет.
Вследствие того, что природный газ может использоваться всегда со значительно более высокой эффективностью, чем твердое топливо из биомассы, целесообразнее использовать метан, полученный из древесины, чем напрямую сжигать твердое биотопливо. Причина: при использовании природного газа для генерации электроэнергии на газо- или паротурбинной электростанции получается до 60% электричества, а при сжигании твердого топлива из биомассы реализовать проекты с выходом электроэнергии свыше 30% очень сложно. Также при децентрализованной выработке электроэнергии до 1 мВт/ч когенерационные газовые электростанции на синтез-газе эффективнее ТЭС, использующих органический циклический процесс (ORC-процесс) и сжигающих твердое биотопливо.
Работа таких теплоэлектростанций основана на последовательности циклов термодинамического процесса циркуляции (ORС − organic rankine cycle) рабочей жидкости с высокой молекулярной массой (термомасло, органические испаряющиеся вещества). Циркуляционный насос закачивает рабочую жидкость в теплообменник высокотемпературного органического теплоносителя, где происходит ее испарение. Пары жидкости приводят в действие турбину, после чего попадают в следующий теплообменник, где они, охлаждаясь водой или воздухом, конденсируются. Конденсат попадает в сборник циркуляционного насоса, и термодинамический цикл (ORC) повторяется. Ни теплоноситель, ни охлаждающая жидкость не находятся в непосредственном контакте с турбиной или рабочей жидкостью. Посредством процесса ORC теплоэлектростанции достигают большой мощности, надежности работы и экономичности.
Даже производство только одной тепловой энергии при применении биометана конкурентоспособно с обычными способами получения тепла. Если отходящее тепло в процессе метанирования древесины используется на месте (децентрализованно), а произведенный газ поступает в газохранилище природного газа, получается общий коэффициент использования 93%, которого не достигают, к примеру, тепловые электростанции, использующие щепу или пеллеты (КПД самой станции ниже и дополнительно имеются потери в тепловых сетях).
Наряду с подготовленным синтез-газом, соответствующим по качеству природному, на крупных газовых ТЭЦ можно использовать и «неочищенный» синтез-газ для совместного сжигания с природным газом, что существенно понизит себестоимость вырабатываемой энергии.
Газ из биомассы или ископаемый природный газ?
Синтетический природный газ (SNG) − это очищенный синтетический газ, который по своим характеристикам идентичен природному газу.
По расчетам компании Agnion, себестоимость производства SNG из щепы в установках до 1 мВт составляет 8–10 евроцентов/кВт•ч.