Можно ли получить фтор по реакции и восстановить цинком
Содержание статьи
Вычисление энергии Гиббса и энтропии химической реакции
Вычисление энергии Гиббса
Задание 101.
Вычислите для следующих реакций:
а) 2NaF (к) + Cl2 (г) = 2NaCl (к) + F2
б) PbO2 (к) + 2Zn (к) = Pb (к) + 2ZnO (к)
Можно ли получить фтор по реакции (а) и восстановить РbO2 цинком по реакции (б). Ответ: +313,94 кДж; -4 17,4 кДж.
Решение:
Реакция имеет вид:
2NaF (к) + Cl2 (г) = 2NaCl (к) + F2
Для вычисления энергии Гиббса прямой реакции используются значения соответствующих веществ, приведённых в специальных таблицах. Зная, что есть функция состояния и, что для простых веществ, находящихся в устойчивом при стандартных условиях агрегатных состояниях, равны нулю, находим , получим:
= 2 (NaCl) — 2(NaF) = 2(-384,03) – 2(-54!,0) = +313,94 кДж.
То, что > 0, указывает на невозможность протекания прямой реакции при Т = 298 К и давлении взятых газов равном 1,01325 Па (760 мм. рт. ст. = 1 атм).
б) Реакция имеет вид:
PbO2 (к) + 2Zn (к) = Pb (к) + 2ZnO (к)
Находим реакции, получим:
= 2(ZnO) — (PbO2) = 2(-318,2) – (-219,0) = -417,4 кДж.
То, что < 0, указывает на возможность протекания прямой реакции при Т = 298 К и давлении взятых газов равном 1,01325 Па (760 мм. рт. ст. = 1 атм).
Ответ: +313,94 кДж; -4 17,4 кДж.
Равновесие системы
Задание 102.
При какой температуре наступит равновесие системы
4НСI (г) + 02 (г) = 2Н2О (г) + 2С12 (г); = -114,42 кДж?
Хлор или кислород в этой системе является более сильным окислителем и при какой температуре? Ответ: 891 К.
Решение:
Уравнение реакции имеет вид:
4НСI (г) + O2 (г) = 2Н2О (г) + 2С12 (г); = -114,42 кДж?
< 0, значит, реакция экзотермическая, идёт с выделением теплоты.
Находим из соотношения:
Для данной реакции:
= 2(Н2О) + 2 (Cl2) – (4 (HCl) + (O2);
= 2(188,72) + 2(222,95) –[ 4(186,69) + 205,03] = 128,41 Дж/моль . К.
Зная и , и, то, что = 0 можно вычислить температуру, при которой наступит равновесие системы, получим:
= — Т
При = 0 получим равенство:
= Т
Тогда
Т = / = 114,42/(128,41 . 10-3) = 891 K.
Находим энергии Гиббса реакции:
= — Т = -114,42 – 298(-0б12841) = -76б15 кДж.
Так как < 0, то реакция при стандартных условиях возможна, т.е. будет идти окисление хлора и при данных условиях (Т = 298) кислород является более сильным окислителем до температуры 891 К, т. е. до тех пор пока не наступит состояние равновесия системы, а выше 891 К более сильным окислителем станет кислород.
Ответ: 891 К.
Задание 103.
Восстановление Fe3O4 оксидом углерода идет по уравнению
Fe3O4 (к) + СО (г) = 3ЕеО (к) + СO2 (г)
Вычислите и сделайте вывод о возможности самопроизвольного протекания этой реакции при стандартных условиях, Чему равно в этом процессе? Ответ. +24,19 кДж; + 31,34 Дж/(моль . К).
Решение:
Реакция имеет вид:
Fe3O4 (к) + СО (г) = 3ЕеО (к) + СO2 (г)
Для вычисления энергии Гиббса прямой реакции используются значения соответствующих веществ, приведённых в специальных таблицах. Зная, что есть функция состояния и, что для простых веществ, находящихся в устойчивом при стандартных условиях агрегатных состояниях, равны нулю, находим , получим:
= 3 (FeO) + (CO2) – [ (Fe3O4) + (CO)];
= 3(-244,3) + (-394,38) — [(-1014,2) + (-137,27) = +24,19 кДж.
То, что > 0, указывает на невозможность протекания прямой реакции при Т = 298 К и давлении взятых газов равном 1,01325 Па (760 мм. рт. ст. = 1 атм).
Находим из соотношения:
Для данной реакции:
= FeО) + (CO2) – [(Fe3O4) + )))э (CO)];
= (3 . 54,0 + 213,65) – (146,4 + 197,91) = +31,34 Дж/моль .К.
Ответ. +24,19 кДж; + 31,34 Дж/(моль . К).
Энтропия системы
Задание 104.
Реакция горения ацетилена идет по уравнению
С2Н2 (г) + 5/2О2 (г) = 2СО2 (г) + Н2О (ж)
Вычислите и . Объясните уменьшение энтропии в результате этой реакции. Ответ: -1235,15 кДж; -216,15 Дж/(моль .К).
Решение:
Реакция имеет вид:
С2Н2 (г) + 5/2О2 (г) = 2СО2 (г) + Н2О (ж)
Для вычисления энергии Гиббса прямой реакции используются значения соответствующих веществ, приведённых в специальных таблицах. Зная, что есть функция состояния и, что для простых веществ, находящихся в устойчивом при стандартных условиях агрегатных состояниях, равны нулю, находим , получим:
= 2 (CO2) + (Н2O) – [(С2Н2) + 5/2(O2)];
= 2(-394,38) + (-237,19) — [(209,20) = -1235,15 кДж.
Энтропия () является функцией состояния, т. е. её изменение зависит только от начального (S1) и конечного (S2) состояний и, не зависит от пути процесса:
Значения находим из специальных таблиц.
Для данной реакции:
= 2S0(СО2) + S0(Н2О) – [( S0(С2Н2) + 5/2 So(O2);
= (2 . 213,65 + 69,94) – (200,82 + 5/2 .205,03) = -216,15 Дж/моль .К.
Уменьшение энтропии объясняется тем, что система в результате реакции переходит в более устойчивое состояние, так как из 3,5 объёмов газообразных веществ происходит образование 2 объёмов газообразных веществ и образуется 1 моль жидкого вещества, т. е. объём системы уменьшается, и агрегатное состояние вещества упорядочивается, < 0.
Ответ: -1235,15 кДж; -216,15 Дж/(моль . К).
Задание 105.
Уменьшается или увеличивается энтропии при переходах: а) воды в пар; б) графита в алмаз? Почему? Вычислите для каждого превращения. Сделайте вывод о количественном изменении энтропии при фазовых и аллотропических превращениях. Ответ: а) 118,78 Дж(моль . К); 6) -3,25 Дж/(моль . К).
Решение:
Энтропия является свойством вещества, пропорциональным его количеству. Она обладает аддитивными свойствами, т. е. при соприкосновении систем суммируется. Энтропия отражает движение частиц вещества и является мерой неупорядоченности системы. Она возрастает с увеличением движения частиц (при нагревании, испарении, плавлении, расширении газа, при ослаблении или разрыве связей между атомами и т.п.), > 0 Процессы, связанные с упорядоченностью системы (конденсация, кристаллизация, сжатие, упорядочение связей, полимеризация и т.п.) ведут к уменьшению энтропии, < 0.
а) Изменение значений энтропии при переходе воды в пар.
При переходе воды в пар энтропия будет возрастать, потому что при испарении воды происходит увеличение движения молекул, т. е. система переходит в менее устойчивое состояние, из жидкого в газообразное, > 0.
Уравнение реакции имеет вид:
Н2О (ж) → Н2О (г);
= [Н2О] (г) — [Н2О] (ж);
= 188,72 – 69,94 = +118,78 Дж/моль . К.
б) Изменение значений энтропии при переходе. При переходе графита в алмаз образуются более прочные связи между атомами углерода в алмазе, чем в графите, т. е. происходит процесс с упорядоченностью системы, упрочнение связей, что ведёт к уменьшению энтропии, < 0.
Уравнение реакции имеет вид:
С (графит) → С (алмаз);
= S0 С (алмаз) — S0С (графит);
= 2,44 – 5,69 = -3,25 Дж/моль . К.
Значения взяты из специальных таблиц.
Ответ: а) 118,78 Дж(моль . К); 6) -3,25 Дж/(моль . К).
Определение энергии Гиббса реакции
Задание 106.
Чем можно объяснить, что при стандартных условиях невозможна экзотермическая реакция
Н2 (г) + СО2 (г) = СО (г) + Н2О (ж); = -2,85 кДж.
Зная тепловой эффект реакции и абсолютные стандартные энтропии соответствующих веществ, определите этой реакции. Ответ: +19,91 кДж.
Решение:
Уравнение реакции имеет вид:
Н2 (г) + СО2 (г) = СО (г) + Н2О (ж); = -2,85 кДж.
Значения находим из специальных таблиц.
Для данной реакции:
= S0(СО) + S0 (Н2О) – [( S0(Н2) + (S0СO2)];
= (197,91 + 69,94) – (130,59 + 213,65) = -76,39 Дж/моль . К.
Теперь вычислим реакции из уравнения Гиббса:
= — Т;
= -2,85 – 298(-76,39) = +19,91 кДж.
То, что > 0, указывает на невозможность протекания прямой реакции при Т = 298 К и давлении взятых газов равном 1,01325 Па (760 мм. рт. ст. = 1 атм).
Ответ: +19,91 кДж.
Задание 107.
Прямая или обратная реакция будет протекать при стандартных условиях в системе
2NO (г) + O2 (г) = 2NO2 (г)
Ответ мотивируйте, вычислив прямой реакции. Ответ: -69,70 кДж.
Решение:
Уравнение процесса:
2NO (г) + O2 (г) = 2NO2 (г)
Для вычисления энергии Гиббса прямой реакции используются значения соответствующих веществ, приведённых в специальных таблицах. Зная, что есть функция состояния и, что для простых веществ, находящихся в устойчивом при стандартных условиях агрегатных состояниях, равны нулю, находим , получим:
= 2(NO2) — 2Г(NO) = 2 . 51,84 – 2 . 86,69 = -69,70 кДж.
То, что < 0, указывает на возможность протекания прямой реакции при Т = 298 К и давлении взятых газов равном 1,01325 Па (760 мм. рт. ст. = 1 атм.), обратная реакция не протекает при н. у..
Ответ: -69,70 кДж.
Источник
Контрольная работа по «Химии»
1. Определите количество вещества
эквивалента и молярную массу эквивалентов
фосфора, кислорода и брома в соединениях
PH3, H2O, HBr.
Решение
Эквивалентом элемента называют
такое его количество, которое
соединяется с 1 молем атомов водорода
или замещает то же количество атомов
водорода в химических реакциях. Молярную
массу эквивалента элемента можно рассчитать
как отношение молярной массы атома элемента
к его валентности.
PH3 количество вещества
эквивалента фософра равно 1/3 моля.
Mэ(Р) = Ar(P)/валентность = 31/3
= 10,3 г/моль.
H2O количество вещества
эквивалента фософра равно 1/2 моля.
Mэ(О) = Ar(О)/валентность = 16/2
= 8 г/моль.
HBr количество вещества
эквивалента фософра равно 1 моль.
Mэ(Br) = Ar(Br)/валентность = 80/1
= 80 г/моль.
Ответ: PH3 1/3моля; 10,3 г/моль; H2O
½ моля; 8 г/моль; HBr – 1 моль;
80 г/моль
21. Напишите электронные формулы
аиомов элементов с порядковыми номерами
9 и 28. Покажите распределение электронов
этих атомов по квантовым ячейкам. К какому
электронному семейству относится каждый
из этих элементов.
Решение
В периодической системе
элементов Д.И. Менделеева под №
9 расположен фтор; под № 28 – никель.
Электронные формулы
атомов элементов
Фтор F 1s22s22p5
Никель Ni 1s22s22p6
3s23p64s23d8
Распределение электронов
элементов по квантовым ячейкам
Фтор
Никель
Фтор относится к семейству р-элементов;
никель – d- элементов.
41. Исходя из положения германия
и технеция в периодической системе, сотавьте
формулы мета- и ортогерманиевых кислот,
и оксида технеция, отвечающие их высшей
степени окисления. Изобразите формулы
этих соединений графически.
Решение
Положение элемента в периодической
системе элементов Д.И. Менделеева
показывает, какими свойствами обладает
тот или иной элемент:
При перемещении вдоль
периода справа налево металлические
свойства элементов усиливаются. В
обратном направлении возрастают неметаллические.
Это объясняется тем, что правее находятся
элементы, электронные оболочки которых
ближе к октету. Элементы в правой части
периода менее склонны отдавать свои электроны
для образования металлической связи
и вообще в химических реакциях. Слева
направо в периоде также увеличивается
и заряд ядра. Следовательно, увеличивается
притяжение к ядру валентных электронов
и затрудняется их отдача.
Германий (Ge) — химический элемент
главной подгрпуппы IV группы 4 периода
Периодической системы химических элементов
Д. И. Менделеева, с атомным номером 32. В
химические соединениях Германий обычно
проявляет валентности 2 и 4, причем более
стабильны соединения 4х-валентного Германия. Метагерманиевая кислота H2GeO3
Ортогерманиевая кислота
H4GeO4
Технеций (Тс) — элемент побочной
подгруппы седьмой группы пятого периода
периодической системы химических элементов
Д. И. Менделеева, атомный номер 43. По химическим
свойствам технеций близок к марганцу
и рению, в соединениях проявляет степени
окисления от −1 до +7. Оксид технеция(VII)
Tc2O7
61. Какую химическую связь называют
ковалентной? Чем можно объяснить направленность
ковалентной связи? Как метод валентных
связей (ВС) объясняет строение молекул
воды?
Решение
Ковалентная связь – химическая связь между атомами,
осуществляемая общей парой электронов.
Если ковалентная связь образована одинаковыми
атомами О=О, то обобществленные электроны
равномерно распределены между ними. В
молекуле О2 кислород образовывает неполярные ковалентные
связи. Если же один атом сильнее притягивает
электроны, то электронная пара смещается
в сторону этого атома, например, как молекуле
воды Н2О. где возникает полярная ковалентная
связь.
Образование ковалентной
связи, являющееся результатом перекрывания
валентных электронных облаков
взаимодействующих атомов, возможно
только при определённой взаимной ориентации
электронных облаков. При этом область
перекрывания располагается в определённом
направлении по отношению к взаимодействующим
атомам. Иначе говоря, ковалентная связь
обладает направленностью.
Представление о направленности
ковалентных связей позволяет объяснить
взаимное расположение атомов в многоатомных
молекулах. Так, например, при образовании
молекулы воды электронные облака двух
неспаренных 2p-электро-нов атома кислорода
перекрываются с 1s-электронными облаками
двух атомов водорода (рисунок 1).
Рисунок 1 – Схема образования
ковалентных связей в молекуле воды
Поскольку p-электронные облака
атома кислорода расположены перпен-
дикулярно друг к другу, то
молекула H2O имеет угловое строение,
причём можно было бы предположить, что
угол между связями O–H должен составлять
90°. На самом же деле углы между связями
(т.е. валентные углы) в молекулах воды
несколько отличаются от 90°.
Для объяснения отличия валентных
углов в молекулах воды от
90° необходимо учесть, что устойчивому
состоянию молекулы отвечает такая её
геометрия и такое пространственное расположение
электронных облаков внешних оболочек
атомов, при которых потенциальная энергия
соединения будет минимальной. Это приводит
к тому, что при образовании соединения
формы и взаимное расположение электронных
облаков атомов изменяются по сравнению
с их формами и взаимным расположением
в свободных атомах. В результате достигается
более полное перекрывание валентных
электронных облаков и, вследствие этого,
образование более прочных ковалентных
связей. В рамках метода валентных связей
такая перестройка электронной структуры
атома рассматривается на основе представления
о гибридизации атомных орбиталей.
81 Вычислите количество
темплоты, которое выделится при восстановлении
Fe2O3 металлическим алюминием,
если было получено 335,1 г железа.
Решение
Тепловой эффект реакции
– количество теплоты, которое выделяется
или поглощается при полном превращении
исходных веществ в продукты реакции
в количествах, равных стехиометрическим
коэффициентам в уравнении.
2Al + Fe2O3 → Al2O3
+ 2Fe
Стандартной теплотой (энтальпией)
образования вещества ∆H2980
называют тепловой эффект реакции образования
1 моля вещества из простых веществ, устойчивых
при стандартных условиях. Теплоты образования
простых веществ равны 0.
Для расчетов используем следствие
из закона Гесса: тепловой эффект реакции
равен сумме теплот образования
продуктов реакции за вычетом
суммы теплот образования исходных веществ
с учетом стехиометрических коэффициентов
n. Функцию состояния системы ∆Hх.р.
находим по формуле:
∆H2980 = ∑n(i)∆H2980(i)
– ∑n (j) ∆H2980(j)
i -продукты
j-исходные вещества
Записываем табличные
значения теплот образования1
2Al | ||||
∆H2980, кДж/моль | -822,16 | -1676 | ||
∆H2980 = -1676 – (-822,16)
= — 853,84 кДж
Определяем количество молей
образовавшегося железа: 335,1/55,84= 6 моль
Составляем пропорцию:
При образовании 2 молей железа
выделилось 853,84 кДж
«-«
6 молей «-«
х
Ответ: 2561,52 кДж
101. Вычислите
∆G2980 для следующих реакций:
а) 2NaF(к) + Cl2(г) = 2
NaCl(к) + F2(г)
б) PbO2(к) + 2Zn(к) = Pb(к) + 2 ZnO(к)
Можно ли получить фтор по реакции
(а) и восстановить PbO2 цинком по
реакции (б).
Решение
Для установления термодинамической
возможности протекания реакции
нужно вычислить энергию Гиббса
реакции при температуре 298К по
уравнению
∆G2980 = ∑n(i)∆G2980(i)
– ∑n (j) ∆G2980(j)
i -продукты
j-исходные вещества
Записываем табличные
значения исходных веществ и продуктов
реакции под формулами веществ
в уравнении реакции (а)
2NaF(к) | ||||
∆G2980, кДж/моль | -540,97 | -384,0 | ||
∆G2980 = 2· (-384,0) –
2 · (-540,97) = 313,95 кДж
Поскольку ∆G2980
= 313,95 кДж>0, то реакция термодинамически
невозможна.
Записываем табличные
значения исходных веществ и продуктов
реакции под формулами веществ
в уравнении реакции (б)
PbO(к) + | ||||
∆G2980, кДж/моль | -224,0 | -320,7 | ||
∆G2980 = 2· (-320,7) –
(-224,0) = — 417,4 кДж
Поскольку ∆G2980
= — 417,4 кДж<0, то реакция термодинамически
возможна.
Ответ: 313,95 кДж; — 417,4 кДж
121. Окисление
серы и ее диоксида протекает по уравнениям:
а) S (к)+ O2 =SO2(г);
б) 2SO2(г) + O2 +2SO3(г)
Как изменится скорость этих
реакций, если объемы каждой из систем
уменьшить в четыре раза?
Решение
Согласно закону действующих
масс, скорости реакций:
V(a) = k1·[O2] (концентрация
твердой фазы — кристаллической серы не
входит в это выражение)
V(б) = k2·[SO2]2
·[O2]
При уменьшении объемов каждой
из систем в 4 раза концентрации реагентов
увеличатся в 4 раза
V1(a) = k1·[4O2]= 4 k1·[O2]
V1(б) = k2·[4SO2]2
·[4O2] =64 k2·[SO2]2 ·[O2]
Для реакции а) соотношение
скорости реакции V1(a)/ V(a) = 4, т.е. скорость
увеличится в 4 раза.
Для реакции б) соотношение
скорости реакции V1(б)/ V(б) = 64, т.е. скорость
реакции увеличится в 64 раза.
Ответ: скорость увеличится для реакции
а) в 4 раза; б) – 64 раза
141. Вычислите
молярную концентрацию и молярную концентрацию
эжквивалента 20%-ного раствора хлорида
кальция плотностью 1,178 г/см3.
Решение
Принимаем объем раствора
за 1 л или 1000 мл. Определяем массу 1 л
раствора
mр-ра = 1000∙1,178= 1178 г
Находим массу CaCl2 в
этом растворе
Рассчитываем молярную концентрацию
раствора
Определяем нормальную концентрацию.
Поскольку фактор эквивалентности
хлорида кальция равен 1/2, то
Ответ: 2,12 М; 4,2 н
161. Раствор, содержащий
0,512 г неэлектролита в 100 г бензола, кристаллизуется
при 5,296оС. Температура кристаллизации
бензола 5,5 оС. Криоскопическая константа
5,1о. Вычислите молярную массу растворенного
вещества.
Решение
Используя данные условия задачи
и температуру замерзания бензола 5,5оС
определим ∆Т.
∆Т = 5,5 – 5,296 = 0,204о
Для определения молярной
массы растворенного вещества воспользуемся
соотношением:
откуда
Ответ: 128 г/моль
181. Составьте
молекулярные и ионно-молекулярные уравнения
реакций взаимодействия в растворах между:
а) NaHCO3 и NaOH; б) K2SiO3
и HCl; в) BaCl2 и Na2SO4
Решение
а) NaHCO3 + NaOH = Na2CO3
+ H2O
Na+ + HCO3−
+ Na+ + OH− = 2Na+ + CO32−
+ H2O
HCO3− + OH−
= CO32− + H2O
б) K2SiO3 + 2HCl(разб.)
= SiO2↓ + 2KCl + H2O
2K+ +SiO32- +2H+
+2Cl- =2K+ +2Cl-+ SiO2↓
+ H2O
SiO32- +2H+
-= SiO2↓ + H2O
в) BaCl2
+ Na2SO4 = BaSO4↓ + 2NaCl
Ba2+ + 2Cl-
+ 2Na+ +SO42- = BaSO4↓
+ 2Na+ + Cl-
Ba2+ + SO42-
= BaSO4↓
Источник
Неуловимый разрушитель | Научно-популярный журнал «Химия и Жизнь»
 Фтор — один из самых удивительных элементов. Он настолько активен, что химики долго не могли его получить в свободном состоянии. В 1886 году удача улыбнулась французскому ученому Анри Муассану — он синтезировал газообразный фтор электролизом жидкого безводного фтористого водорода с примесью кислого фторида калия. Этим способом фтор и сегодня получают в промышленности. Но можно ли получить фтор чисто химическим путем? Это удалось сделать только через 100 лет после Муассана, в 1986 году.
Фтор — один из самых удивительных элементов. Он настолько активен, что химики долго не могли его получить в свободном состоянии. В 1886 году удача улыбнулась французскому ученому Анри Муассану — он синтезировал газообразный фтор электролизом жидкого безводного фтористого водорода с примесью кислого фторида калия. Этим способом фтор и сегодня получают в промышленности. Но можно ли получить фтор чисто химическим путем? Это удалось сделать только через 100 лет после Муассана, в 1986 году.
Название этого элемента в русском языке происходит от греческого слова φθορος (разрушение), а в английском fluorine — от латинского fluere (течь). Учитывая свойства элементного фтора взаимодействовать почти со всеми элементами, греческое название явно удачней латинского.
Соединения фтора известны человечеству очень давно. Фторид кальция (плавиковый шпат CaF2) использовали еще в древности для изготовления украшений и посуды, поскольку этот прозрачный красивый минерал бывает самых разных оттенков. Первые научные упоминания о фториде кальция можно найти в конце XV века (в трудах алхимика Василия Валентина) и в начале XVI (работы Георгия Агриколы).
В 1670 году Генрих Шванхард обратил внимание, что если смесь фторида кальция с серной кислотой накрыть стеклом, то оно разъедается (и даже, как пишут, таким способом создавал узоры на бокалах). Эту же смесь подробно изучил в 1768 году немецкий химик Андреас Сигизмунд Маргграф. Ученый ее дистиллировал и получил неизвестную жидкость (водный раствор смеси фторкремниевой кислоты H2SiF6 и фтороводорода HF), которую назвал «летучая земля», поскольку продукт был получен из природного минерала и там явно присутствовал летучий компонент. Через четыре года Карл Вильгельм Шееле повторил эксперимент Маргграфа и сделал правильный вывод, что фтороводород — это кислота. Разделить смесь фторкремниевой и фтористоводородной кислот смогли в начале XIX века Жозеф Луи Гей-Люсcак и Луи Жак Тенар — именно они первые получили чистую плавиковую кислоту (HF), и оба получили отравление.
Идея, что фтор — новый элемент, похожий на хлор, родилась в переписке Хэмфри Дэви, незадолго до этого установившего элементарную природу хлора, и Андре Мари Ампера. Обсуждая результаты взаимодействия серной кислоты с фторидом кальция, в 1810 году Ампер предположил, а Дэви с ним согласился, что получается вещество, аналогичное хлористоводородной кислоте HCl, а значит, должен существовать новый элемент. Именно тогда Ампер предложил назвать новый элемент фтором, учитывая его разрушающее действие, а Дэви настаивал на другом варианте – флюорин по аналогии с хлором.
Следующим шагом должен был стать синтез нового элемента в чистом виде, но это оказалось чрезвычайно непростой задачей. Элемент вел себя слишком активно и реагировал со всем, что его окружало: с водой, со стенками сосуда. Из-за попыток выделить фтор в чистом виде погибло как минимум четыре исследователя, а другие (в том числе Гей-Люссак, Тенар, Дэви) сильно подорвали свое здоровье.
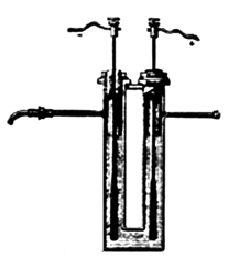 |
Аппарат Муассана для получения фтора |
Рискуя жизнью, химики сделали немало попыток получить фтор в свободном состоянии. Уже было понятно, что правильный путь — это электролиз, но все как-то не складывалось. Главная проблема, с которой столкнулись ученые при электролизе расплавленных фторидов, — выделяющийся фтор реагировал практически с любым материалом анода (углеродом, золотом, платиной и проч.). Наконец французский химик Анри Муассан в 1886 году построил из платины U-образный электролизер (см. рис.) и продемонстрировал Парижской академии наук получение газообразного фтора. В качестве электролита он использовал безводную плавиковую кислоту, но, поскольку она в безводном состоянии не проводит электричества, он растворил в ней небольшое количество гидродифторида калия КНF2.В аппарате Муассана было еще одно удачное решение: U-образный электролизер сильно охлаждали (до –23°С), чтобы уменьшить давление паров фтороводорода. Электроды, сделанные из платины, изолировали плавиковым шпатом, который не реагировал с фтором. Кстати, потом выяснилось, что можно использовать обычную медь, поскольку на ее поверхности довольно быстро образуется защитная пленка из фторида меди, которая защищает электрод. В результате на катоде зафиксировали выделение водорода, а на аноде — неизвестного газа, который и назвали фтором. Позднее методику Муассана немного модифицировали (сейчас, в частности, используют стальной катод, который реагирует с фтором, но не так быстро, как другие материалы, и угольный анод), однако не придумали ничего принципиально нового.
А как же обстояли дела с химическим синтезом фтора? Попытки получить его чисто химическим способом предпринимали и до Муассана. Некоторые из экспериментов, возможно, были удачными по сути, но трудности возникали при попытке собрать хоть какое-то ощутимое количество газа. Первое, что пытались сделать, — термически разложить фториды ртути, серебра и платины. Их разложение не давало никаких результатов, если фторид был сухим, и приводило к образованию фтористого водорода, когда фторид был влажным. По идее, эксперименты по разложению фторидов могли привести к получению фтора, но, к сожалению, исходные реагенты были подобраны неудачно. Также химики пытались разложить фториды церия CeF4·H2O и CeF4·3KF·2H2O, свинца PbF4, K3HPbF8 и K2MnF5 — они при нагревании дают газ, напоминающий по запаху фтор. Еще до успешного эксперимента с электролизом фторида калия Муассан провел множество неудачных попыток получить фтор разложением разнообразных фторидов с помощью электрического разряда — тетрафторида кремния SiF4, трифторида фосфора PF3, пентафторида фосфора PF5, трифторида бора BF3 и трифторида мышьяка AsF3.
Надо также отметить, что Дэви пытался вытеснить фтор из фторидов калия, натрия, ртути и серебра с помощью хлора, брома и иода. Георг Нокс и Томас Нокс пробовали вытеснить фтор из фторидов ртути и свинца хлором. К сожалению, никакого фтора таким образом получить не удалось. Исследовали и другие реакции: взаимодействие фторида бора BF3 и оксида свинца Pb3O4; HF и HNO3; CaF2 и перманганата калия KMnO4; HF и дихромата калия K2Cr2O7. И опять проблема была в неудачном выборе веществ.
Лишь спустя сто лет сотрудник американской корпорации «Rockwell International» Карл Кристе («Inorganic Chemistry», 1986, т. 25, с. 3722) предложил химический метод получения фтора в более-менее достаточных для измерения количествах. В принципе он не слишком отличается от описанных ранее, кроме того, что он более эффективен. К тому же ни один из исходных реагентов не был синтезирован с использованием газообразного фтора — это дает повод утверждать, что история этого элемента могла пойти по другому пути.
Кристе использовал произвольное разложение тетрафторида марганца MnF4, образующегося при реакции замещения между K2MnF6 и SbF5: 2K2MnF6 + 4SbF5 = 4KSbF6 + 2MnF3 + F2.
Известно, что кинетически или термодинамически нестабильные фториды переходных металлов можно стабилизировать, превратив их в полифторидный анион. Например, фторид никеля NiF4, фторид меди CuF4 или MnF4 стабилизируют, трансформируя их в анионы типа MF6- (М — металл). Потом этот анион можно восстановить с помощью более сильного акцептора электронов, то есть более сильной кислоты Льюиса (к примеру, SbF5), после чего образующееся вещество моментально разлагается с выделением газообразного фтора. Реакция происходит в стальном реакторе, покрытом тефлоном, при температуре 190°С всего за час. И этот метод намного безопаснее, чем электролиз Муассана.
Надо сказать, что Карл Кристе описал еще и очень интересный метод хранения фтора. Проблема в том, что его нельзя держать в стальном цилиндре под большим давлением (сейчас фтор собирают и хранят в обыкновенном стальном баллоне под давлением не больше 4 атм., а желательное давление 4—10 атм.), поэтому Кристе предложил хранить фтор в виде смеси фторида калия и K2NiF6. При ее нагревании до 400°С начинается выделение фтора и образование K3NiF6, а при охлаждении до 250°С происходит обратная реакция — фтор поглощается. Для получения и хранения фтора можно использовать и другие, родственные K2MnF6 и K2NiF6 соединения.
Конечно, эта реакция Кристе не может составить конкуренцию промышленному методу получения фтора (выход в ней около 30%), однако по своему теоретическому значению она занимает почетное место как завершающая жирная точка в деле о фторе.
Собственно, а почему такое внимание этому элементу? Есть ведь и другие галогены. Одна из причин — фтор позволил открыть целую новую область: благодаря ему удалось синтезировать первые соединения благородных газов. Их считали абсолютно инертными, а оказалось, что фтор в отличие от других галогенов с ними реагирует. На сегодня известны фторидные соединения трех из шести элементов группы гелия, причем химия двух из них изучена достаточно подробно. Благодаря фтору удалось также синтезировать оксидные соединения ксенона и криптона. В стороне остался радон по причине своей радиоактивности — дифторид радона получили, но выход весьма невелик, и авторадиолиз быстро уничтожает полученый образец.
Надо отметить, что работы по неорганической химии фтора — это удовольствие для очень немногих лабораторий. Нужно специальное дорогостоящее оборудование, которое могут позволить себе далеко не все. И сам элементный фтор, необходимый для синтеза многих фторидов, — тоже стоит дорого.
Но самое главное применение фтора, из-за которого, собственно, его и производят в промышленных масштабах ,— без него невозможно обогащение урана. Поэтому все истории о фторе имеют ореол загадочности. Для обогащения урана используют гексафторид урана UF6, а чтобы его получить, необходим элементный фтор и соответствующее оборудование (вот почему частные лица это делать не могут). Если какое-то государство решило развернуть исследования с использованием элементного фтора, то можно быть уверенным, что очень скоро его обвинят в попытке разработать собственную ядерную программу. Вот почему фтор занимает особое место в неорганической химии, и изучение его соединений, несомненно, будет продолжаться.
Источник