Можно ли из воды получить кислород уравнение
Содержание статьи
Как получить из воды кислород
17 августа 2011
Автор
КакПросто!
Кислород можно выделить из многих химических соединений. Для промышленных целей кислород чаще всего получают путем сжижения воздуха с одновременной очисткой. Но кислород можно получить и из воды. Правда, в домашних условиях или в школьной лаборатории его может получиться совсем немного. Для этого нужно разделить молекулу воды на атомы кислорода и водорода.
Вам понадобится
- -вода;
- -серная кислота;
- -источник постоянного тока напряжением 6-12 В;
- -гальваническая банка (прямоугольный стеклянный сосуд объемом 5-8 л);
- -угольные электроды от электрической батарейки;
- — 2 прозрачных пластмассовых стакана;
- -битум;
- -трубка от капельницы;
- -пробирка;
- -стеклянная банка;
- -паяльник;
- -2 провода.
Инструкция
Возьмите пластмассовый стакан. Сделайте в его дне отверстие и вставьте в него электрод так, чтобы он располагался углем внутрь стакана. Место соединения электрода и стакана изолируйте битумом со стороны дна. Точно так же обработайте и второй стакан для второго электрода. К металлической части каждого электрода припаяйте провод. Лучше взять провода разного цвета, например, красный и синий.
В гальваническую ванну залейте воду примерно на 2/3 высоты. Добавьте туда 1-2 мл разведенной серной кислоты. Концентрация большого значения не имеет, поскольку серная кислота нужна только для поляризации воды.
Установите стаканы с электродами так, чтобы электроды были погружены в воду, а количество воздуха между поверхностью воды и днищем стакана по возможности было минимальным. Подключите электроды к клеммам источника тока. Например, подключите красный провод к аноду, а синий — к катоду. Сквозь прозрачные стенки гальванической ванны и стаканов наблюдайте, как около электродов начинают образовываться пузырьки, которые поднимаются вверх и скапливаются внутри стаканов. Происходит следующая реакция: 2(H2O)→2H2+O2. Около катода (отрицательного электрода) скапливаются молекулы водорода, а около анода — молекулы кислорода.
С помощью трубки от капельницы можно отвести тот или иной газ в банку с водой и наполнить с его помощью пробирку для анализа. Например, в кислороде можно сжечь докрасна раскаленную металлическую проволоку. Водород же горит сам. Нужно помнить, что в ходе эксперимента надо избегать смешивания этих газов, а также смешивания водорода с воздухом.
Количество кислорода, полученное при данном эксперименте, невелико, потому что он активно вступает во взаимодействие с угольным электродом и поглощается им, дополнительно образуя углекислый газ в качестве примеси. Для получения большего количества кислорода понадобится инертный анод. Такой анод можно изготовить из пластины платины либо из металлической пластины, покрыв ее слоем золота или палладия.
Обратите внимание
В качестве источника тока можно использовать автомобильный аккумулятор.
Не забудьте, что при реакции образуется не только кислород, но и водород. Он при наличии загрязнителей становится взрывоопасным.
Полезный совет
Для этого эксперимента лучше брать дистиллированную воду. В крайнем случае, можно использовать кипяченую. Вода из-под крана не подойдет, поскольку чаще всего содержит хлор. Кроме этого, при использовании воды из-под крана на электродах может образоваться накипь.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google
Privacy Policy and
Terms of Service apply.
Источник
Как выделить кислород и водород из воды электролизом
Процесс расщепления воды (H2O) на ее составляющие (водород и кислород) с помощью электричества называется электролизом. Полученные в результате электролиза газы можно использовать сами по себе — например, водород служит одним из чистейших источников энергии. Хотя название данного процесса, возможно, и звучит несколько заумно, на самом деле это проще, чем может показаться, если у вас есть подходящее оборудование, знания и немного опыта.
Подготовьте оборудование
1
Возьмите стакан объемом 350 миллилитров и налейте в него теплую воду. Нет необходимости заполнять стакан до краев, хватит небольшого количества воды. Подойдет и холодная вода, хотя теплая лучше проводит электричество.[1]
- Подойдет как водопроводная, так и бутилированная вода.
- Теплая вода имеет меньшую вязкость, благодаря чему в ней легче перемещаются ионы.
2
Растворите в воде 1 столовую ложку (20 граммов) поваренной соли. Насыпьте в стакан соль и перемешайте воду, чтобы она растворилась. В результате у вас получится солевой раствор.[2]
- Хлорид натрия (то есть поваренная соль) является электролитом, который увеличивает электропроводность воды. Сама по себе вода плохо проводит электричество.
- После того как вы повысите электропроводность воды, созданный батарейкой ток будет легче проходить через раствор и эффективнее расщеплять молекулы на водород и кислород.
3
Заточите два твердо-мягких карандаша с обоих концов, чтобы обнажился графитовый стержень. Не забудьте снять с карандашей ластик. На обоих концах должен выступить графитовый стержень.[3]
- Графитовые стержни послужат изолированными электродами, к которым вы подключите батарейку.
- Графит хорошо подходит для данного эксперимента, поскольку он не растворяется и не корродирует в воде.
4
Вырежьте достаточно большой лист картона, чтобы его можно было положить поверх стакана. Используйте довольно толстый картон, который не провиснет после того, как вы проделаете в нем два отверстия. Вырежьте квадратный кусок из коробки для обуви или чего-нибудь подобного.[4]
- Картон нужен для того, чтобы удерживать карандаши в воде, так чтобы они не касались стенок и дна стакана.
- Картон не проводит ток, поэтому его можно без опаски положить на стакан.
5
Проделайте с помощью карандашей два отверстия в картоне. Проткните картон карандашами — в этом случае они окажутся плотно зажатыми и не будут выскальзывать. Проследите, чтобы графит не касался стенок или дна стакана, иначе это помешает провести эксперимент.[5]
Проведите эксперимент
1
Подсоедините к каждой клемме батарейки по одному проводу с зажимами «крокодил». Источником электрического тока послужит батарейка, и через провода с зажимами и графитовые стержни ток достигнет воды. Подключите один провод с зажимом к положительному, а второй — к отрицательному полюсу батарейки.[6]
- Используйте 6-вольтовую батарейку. Если у вас нет такой батарейки, вместо нее можно взять 9-вольтовую батарейку.
- Подходящую батарейку можно приобрести в магазине электрических товаров или супермаркете.
2
Подсоедините вторые концы проводов к карандашам. Как следует закрепите металлические зажимы проводов на графитовых стержнях. Возможно, придется счистить с карандашей еще немного дерева, чтобы зажимы не соскальзывали с графитовых стержней.[7]
- Таким образом вы замкнете цепь, и через воду потечет ток от батарейки.
3
Положите картон на стакан так, чтобы свободные концы карандашей погрузились в воду. Лист картона должен быть достаточно большим, чтобы устойчиво лежать на стакане. Действуйте аккуратно, чтобы не нарушить правильное расположение карандашей.[8]
- Чтобы эксперимент удался, графит не должен касаться стенок и дна стакана. Еще раз проверьте это и при необходимости поправьте карандаши.
4
Понаблюдайте, как вода расщепляется на водород и кислород. От опущенных в воду графитовых стержней начнут подниматься пузырьки газа. Это водород и кислород. Водород будет выделяться на отрицательном, а кислород — на положительном полюсе.[9]
- Как только вы подключите провода к батарейке и графитовым стержням, через воду потечет электрический ток.
- Больше пузырьков газа будет образовываться на том карандаше, который подсоединен к отрицательному полюсу, поскольку каждая молекула воды состоит из двух атомов водорода и одного атома кислорода.
Советы
- Если у вас нет карандашей с графитовыми стержнями, вместо них можно использовать две небольшие проволочки. Просто оберните одним концом каждой проволочки соответствующий полюс батарейки, а второй опустите в воду. Получится тот же результат, что и с карандашами.
- Попробуйте использовать другую батарейку. От вольтажа батарейки зависит величина протекающего тока, которая, в свою очередь, влияет на скорость расщепления молекул воды.
Предупреждения
- Если вы добавите в воду электролит, например соль, то учтите, что в ходе эксперимента будет образовываться небольшое количество такого побочного продукта, как хлор. В таких малых количествах он безопасен, однако вы можете почувствовать легкий запах хлора.
- Проводите данный эксперимент под наблюдением взрослых. Он связан с электричеством и газами, поэтому может представлять опасность, хотя это маловероятно.
Что вам понадобится
- Два твердо-мягких карандаша
- Одна 6- или 9-вольтовая батарейка
- Стакан объемом 350 миллилитров
- 2 провода с с зажимами «крокодил»
- Точилка для карандашей
- Поваренная соль
Об этой статье
Эту страницу просматривали 62 240 раз.
Была ли эта статья полезной?
Источник
Кислород и его получение
Здравствуйте. Вы уже читали мои статьи в блоге Tutoronline.ru. Сегодня я расскажу Вам о кислороде и о способах его получения. Напоминаю, если у Вас будут ко мне вопросы, Вы можете писать их в комментариях к статье. Если же Вам понадобиться любая помощь по химии, записывайтесь на мои занятия в расписании. Буду рад Вам помочь.
Кислород распространён в природе в виде изотопов 16О, 17О, 18О, которые имеют следующее процентное содержание на Земле – 99,76%, 0,048%, 0,192% соответственно.
В свободном состоянии кислород находится в виде трёх алло-тропных модификаций: атомарного кислорода — Оо , дикислорода – О2 и озона – О3. Причём, атомарный кислород может быть получен следующим образом:
КClO3 = KCl + 3O0
KNO3 = KNO2 + O0
Кислород входит в состав более 1400 различных минералов и органических веществ, в атмосфере его содержание составляет 21% по объёму. А в человеческом теле содержится до 65% кислорода. Кислород газ без цвета и запаха, мало растворим в воде (в 100 объёмах воды при 20оС растворяется 3 объёма кислорода).
В лаборатории кислород получают умеренным нагреванием некоторых веществ:
1) При разложении соединений марганца (+7) и (+4):
2KMnO4 → K2MnO4 + MnO2 + O2
перманганат манганат
калия калия
2MnO2 → 2MnO + O2
2) При разложении перхлоратов:
2KClO4 → KClO2 + KCl + 3O2
перхлорат
калия
3) При разложении бертолетовой соли (хлората калия).
При этом образуется атомарный кислород:
2KClO3 → 2 KCl + 6O0
хлорат
калия
4) При разложении на свету солей хлорноватистой кислоты — гипохлоритов:
2NaClO → 2NaCl + O2
Ca(ClO)2 → CaCl2 + O2
5) При нагревании нитратов.
При этом образуется атомарный кислород. В зависимости от того, какое положение в ряду активности занимает металл нитрата, образуются различные продукты реакции:
2NaNO3 → 2NaNO2 + O2
Ca(NO3)2 → CaO + 2NO2 + O2
2AgNO3 → 2 Ag + 2NO2 + O2
6) При разложении пероксидов:
2H2O2 ↔ 2H2O + O2
7) При нагревании оксидов неактивных металлов:
2Аg2O ↔ 4Аg + O2
Данный процесс имеет актуальное значение в быту. Дело в том, что посуда, изготовленная из меди или серебра, имея естественный слой оксидной плёнки, при нагревании образует активный кислород, что является антибактериальным эффектом. Растворение солей неактивных металлов, особенно нитратов, также приводит к образованию кислорода. Например, суммарный процесс растворения нитрата серебра можно представить по этапам:
AgNO3 + H2O → AgOH + HNO3
2AgOH → Ag2O + O2
2Ag2O → 4Ag + O2
или в суммарном виде:
4AgNO3 + 2H2O → 4Ag + 4HNO3 + 7O2
8) При нагревании солей хрома высшей степени окисления:
4K2Cr2O7 → 4K2CrO4 + 2Cr2O3 + 3 O2
бихромат хромат
калия калия
В промышленности кислород получают:
1) Электролитическим разложением воды:
2Н2О → 2Н2 + О2
2) Взаимодействием углекислого газа с пероксидами:
СО2 + К2О2 →К2СО3 + О2
Данный способ представляет собой незаменимое техническое решение проблемы дыхания в изолированных системах: подводных лодках, шахтах, космических аппаратах.
3) При взаимодействии озона с восстановителями:
О3 + 2КJ + H2O → J2 + 2KOH + O2
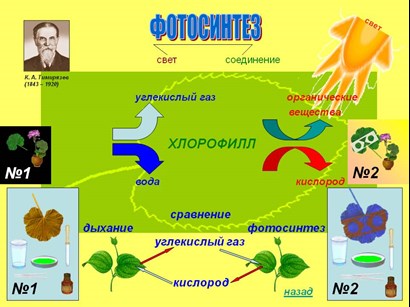 Особое значение получение кислорода имеет место в процессе фотосинтеза, происходящего в растениях. Кардинальным образом от этого процесса зависит вся жизнь на Земле. Фотосинтез – сложный многоступенчатый процесс. Начало ему даёт свет. Сам фотосинтез состоит из двух фаз: световой и темновой. В световую фазу пигмент хлорофилл, содержащийся в листьях растений, образует так называемый «светопоглощающий» комплекс», который отнимает электроны у воды, и тем самым расщепляет её на ионы водорода и кислород:
Особое значение получение кислорода имеет место в процессе фотосинтеза, происходящего в растениях. Кардинальным образом от этого процесса зависит вся жизнь на Земле. Фотосинтез – сложный многоступенчатый процесс. Начало ему даёт свет. Сам фотосинтез состоит из двух фаз: световой и темновой. В световую фазу пигмент хлорофилл, содержащийся в листьях растений, образует так называемый «светопоглощающий» комплекс», который отнимает электроны у воды, и тем самым расщепляет её на ионы водорода и кислород:
2Н2О = 4е + 4Н + О2
Накопившиеся протоны способствуют синтезу АТФ:
АДФ + Ф = АТФ
В темновую фазу происходит преобразование углекислого газа и воды в глюкозу. И побочно выделяется кислород:
6СО2 + 6Н2О = С6Н12О6 + О2
© blog.tutoronline.ru,
при полном или частичном копировании материала ссылка на первоисточник обязательна.
Источник
Урок 17. Получение кислорода
В уроке 17 «Получение кислорода» из курса «Химия для чайников» выясним, как получают кислород в лабораторных условиях; узнаем, что такое катализатор, и как растения влияют на производство кислорода на нашей планете.
Наиболее важным для человека и других живых организмов веществом, входящим в состав воздуха, является кислород. Большие количества кислорода используются в промышленности, поэтому важно знать, как можно его получать.
Получение кислорода в лабораторных условиях
В химической лаборатории кислород можно получать нагреванием некоторых сложных веществ, в состав которых входят атомы кислорода. К числу таких веществ относится вещество KMnO4, которое имеется в вашей домашней аптечке под названием «марганцовка».
Вы знакомы с простейшими приборами для получения газов. Если в один из таких приборов поместить немного порошка KMnO4 и нагреть, то будет выделяться кислород (рис. 76):
Кислород можно также получить разложением пероксида водорода H2O2. Для этого в пробирку с H2O2 следует добавить очень небольшое количество особого вещества — катализатора — и закрыть пробирку пробкой с газоотводной трубкой (рис. 77).
Для данной реакции катализатором является вещество, формула которого MnO2. При этом протекает следующая химическая реакция:
Обратите внимание на то, что ни в левой, ни в правой частях уравнения формулы катализатора нет. Его формулу принято записывать в уравнении реакции над знаком равенства. Для чего же добавляется катализатор? Процесс разложения H2O2 при комнатных условиях протекает очень медленно. Поэтому для получения заметных количеств кислорода необходимо много времени. Однако эту реакцию можно резко ускорить путем прибавления катализатора.
Катализатор — это вещество, которое ускоряет химическую реакцию, но само в ней не расходуется.
Именно потому, что катализатор не расходуется в реакции, мы не записываем его формулу ни в одной из частей уравнения реакции.
Еще один способ получения кислорода — разложение воды под действием постоянного электрического тока. Этот процесс называется электролизом воды. Получить кислород можно в приборе, схематично изображенном на рисунке 78.
При этом протекает следующая химическая реакция:
Кислород в природе
Огромное количество газообразного кислорода содержится в атмосфере, растворено в водах морей и океанов. Кислород необходим всем живым организмам для дыхания. Без кислорода невозможно было бы получать энергию за счет сжигания различных видов топлива. На эти нужды ежегодно расходуется примерно 2% атмосферного кислорода.
Откуда берется кислород на Земле и почему его количество остается примерно постоянным, несмотря на такой расход? Единственным источником кислорода на нашей планете являются зеленые растения, производящие его под действием солнечного света в процессе фотосинтеза. Это очень сложный процесс, включающий много стадий. В результате фотосинтеза в зеленых частях растений углекислый газ и вода превращаются в глюкозу C6h22O6 и кислород. Суммарное
уравнение реакций, протекающих в процессе фотосинтеза, можно представить следующим образом:
Установлено, что примерно одну десятую часть (11%) производимого зелеными растениями кислорода дают наземные растения, а остальные девять десятых (89%) — водные растения.
Получение кислорода и азота из воздуха
Огромные запасы кислорода в атмосфере позволяют получать и использовать его в различных производствах. В промышленных условиях кислород, азот и некоторые другие газы (аргон, неон) получают из воздуха.
Для этого воздух сначала превращают в жидкость (рис. 79) путем охлаждения до такой низкой температуры, при которой все его компоненты переходят в жидкое агрегатное состояние.
Затем эту жидкость медленно нагревают, в результате чего при разных температурах происходит последовательное выкипание (т. е. переход в газообразное состояние) веществ, которые содержатся в воздухе. Собирая выкипающие при разных температурах газы, по отдельности получают азот, кислород и другие вещества.
Краткие выводы урока:
- В лабораторных условиях кислород получают разложением некоторых сложных веществ, в состав которых входят атомы кислорода.
- Катализатор — вещество, которое ускоряет протекание химической реакции, но само при этом не расходуется.
- Источником кислорода на нашей планете являются зеленые растения, в которых протекает процесс фотосинтеза.
- В промышленности кислород получают из воздуха.
Надеюсь урок 17 «Получение кислорода» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Хотите ещё проще? Мы создали новый курс, где максимум за 7 дней вы овладете химией с нуля. Подробннее по ссылке
Источник
Как создать воду из водорода и кислорода
https://unsplash.com/photos/_y4LGVTeBwQ
Вода — это общее название монооксида диоксида водорода или H2O.
Молекула образуется в результате многочисленных химических реакций, включая реакцию синтеза ее элементов, водорода и кислорода.
Сбалансированное химическое уравнение для реакции таково:
2 H2 + O2 + O2 → 2 H2O
Как сделать воду
Теоретически, легко сделать воду из водорода и кислорода.
Нужно смешать два вещества вместе, добавить достаточное количество тепла, чтобы обеспечить энергию активации для начала реакции.
Простое же смешивание двух газов при комнатной температуре, однако, ничего не даст, так как молекулы водорода и кислорода в воздухе не образуют спонтанно реакцию.
Для разрыва ковалентных связей, удерживающих молекулы H2 и O2 вместе, необходима энергия.
Затем катионы водорода и анионы кислорода свободно вступают в реакцию друг с другом, делают они это из-за различий в их электроотрицательности.
Когда химические связи восстанавливаются, образуя воду, высвобождается дополнительная энергия, которая распространяет реакцию. Чистая реакция является высоко экзотермической, т.е. реакцией, сопровождающейся выделением тепла.
Две демонстрации
Одной из распространенных химических демонстраций является наполнение небольшого воздушного шарика водородом и кислородом и прикосновение к воздушному шару — с расстояния и за щитом безопасности — горящей шиной.
Более безопасным вариантом является наполнение воздушного шара газом водорода и зажигание воздушного шара в воздухе.
Ограниченный кислород в воздухе реагирует на образование воды, но в более контролируемой реакции.
Еще одна простая демонстрация заключается в пузырьке водорода добавленного в мыльную воду.
Пузырьки плавают, потому что они легче воздуха.
Зажигалка с длинной рукояткой или горящая шина может быть использована для зажигания и образования воды.
Можно использовать водород из баллона со сжатым газом или в результате нескольких химических реакций (например, реакции кислоты с металлом).
Понимание реакции
https://unsplash.com/photos/1WKZQb6bB-4
Французский химик назвал водород греческим словом водообразующий, основываясь на его реакции с кислородом.
Он был очарован реакцией горения. Для наблюдения за реакцией он разработал аппарат для формирования воды из водорода и кислорода.
По сути, в его установке использовались две емкости — одна для водорода, а другая для кислорода, — которые подавались в отдельный контейнер.
Искровой механизм инициировал реакцию, образуя воду.
Можно сконструировать устройство таким же образом, если тщательно контролировать расход кислорода и водорода, чтобы не пытаться одновременно образовывать слишком много воды. Также следует использовать термостойкий и ударопрочный контейнер.
Роль кислорода
В то время как ученые более раннего периода были знакомы с процессом образования воды из водорода и кислорода, французский ученый открыл для себя роль кислорода в горении.
Его исследования в конечном итоге опровергли теорию флогистонов, которая предполагала, что во время горения из вещества выделяется огнеподобный элемент под названием флогистон.
Он показал, что газ должен иметь массу для горения и что масса должна быть сохранена после реакции.
Реакция водорода и кислорода для получения воды была отличной реакцией окисления для изучения, потому что почти вся масса воды поступает из кислорода.
Почему мы не можем просто сделать воду?
https://unsplash.com/photos/eMX1aIAp9Nw
Согласно оценкам, приведенным в докладе Организации Объединенных Наций за 2006 год, 20% населения планеты не имеют доступа к чистой питьевой воде.
Если так трудно очистить воду или опреснить морскую воду, вам может быть интересно, почему мы просто не делаем воду из ее элементов.
Реакция водорода и кислорода в основном заключается в сжигании водорода газом, за исключением того, что вместо того, чтобы использовать ограниченное количество кислорода в воздухе, вы разжигаете огонь.
Во время горения кислород добавляется в молекулу, которая в результате этой реакции образует воду.
Горение также высвобождает много энергии. Тепло и свет выделяются настолько быстро, что ударная волна расширяется наружу.
Чем больше воды делать за один раз, тем сильнее взрыв. Это работает для запуска ракет.
Таким образом, мы можем делать воду из водорода и кислорода, а химики и педагоги часто делают это в небольших количествах.
Нецелесообразно использовать этот метод в больших масштабах из-за опасности и гораздо более дорогостоящей очистки водорода и кислорода для протекания реакции, чем для получения воды другими способами, очистки загрязненной воды или конденсации водяного пара из воздуха.
Источник