Можно ли из этилена получить бензол
Содержание статьи
Способы получения аренов | CHEMEGE.RU
Арены (ароматические углеводороды) – это непредельные (ненасыщенные) циклические углеводороды, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с замкнутой системой сопряженных связей.
Общая формула: CnH2n–6при n ≥ 6.
Строение, номенклатура и изомерия ароматических углеводородов
Способы получения ароматических углеводородов
Химические свойства ароматических углеводородов
1. Реакция Вюрца-Фиттига
Хлорбензол реагирует с хлорметаном и натрием. При этом образуется смесь продуктов, одним из которых является толуол:
2. Дегидроциклизация алканов
Алканы с углеродной цепью, содержащей 6 и более атомов углерода в главной цепи, при дегидрировании образуют устойчивые шестиатомные циклы, т. е. циклогексан и его гомологи, которые далее превращаются в ароматические углеводороды.
Гексан при нагревании в присутствии оксида хрома (III) в зависимости от условий может образовать циклогексан и потом бензол:
Гептан при дегидрировании в присутствии катализатора образует метилциклогексан и далее толуол:

3. Дегидрирование циклоалканов
При дегидрировании циклогексана и его гомологов при нагревании в присутствии катализатора образуется бензол или соответствующие гомологи бензола.
Например, при нагревании циклогексана в присутствии палладия образуется бензол и водород
Например, при нагревании метилциклогексана в присутствии палладия образуется толуол и водород
4. Декарбоксилирование солей бензойной кислоты
Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении.
R–COONa + NaOH → R–H + Na2CO3
Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты.
Взаимодействие бензоата натрия с гидроксидом натрия в расплаве протекает аналогично реакции получения алканов по реакции Дюма с образованием бензола и карбоната натрия:
5. Алкилирование бензола и его гомологов
- Арены взаимодействуют с галогеналканами в присутствии катализаторов (AlCl3, FeBr3 и др.) с образованием гомологов бензола.
Например, бензол реагирует с хлорэтаном с образованием этилбензола
- Ароматические углеводороды взаимодействуют с алкенами в присутствии хлорида алюминия, бромида железа (III), фосфорной кислоты и др.
Например, бензол реагирует с этиленом с образованием этилбензола
Например, бензол реагирует с пропиленом с образованием изопропилбензола (кумола)

- Алкилирование спиртами протекает в присутствии концентрированной серной кислоты.
Например, бензол реагирует с этанолом с образованием этилбензола и воды
6. Тримеризация ацетилена
При нагревании ацетилена под давлением над активированным углем молекулы ацетилена соединяются, образуя бензол.

При тримеризации пропина образуется 1,3,5-триметилбензол.

7. Получение стирола
Стирол можно получить дегидрированием этилбензола:
Стирол можно также получить действием спиртового раствора щелочи на продукт галогенирования этилбензола (1-хлор-1-фенилэтан):
Источник
Бензол — получение и химические свойства
Что такое бензол?
Бензол – это органическое вещество, при обычных условиях представляет собой бесцветную жидкость со специфическим сладковатым запахом. Является простейшим ароматическим углеводородом. Входит в состав сырой нефти. Не растворим в воде, сильно токсичен. Химическая формула C6H6. Первый раз был получен Майклом Фарадеем, который выделил его из конденсата светильного газа (смесь водорода 50 %, метана 34 %, угарного газа 8 %).
Физические и химические свойства
Молярная масса равна 78,11 г/моль. При температуре 80,1 °C начинает кипеть, при -5 °С — плавиться. Плотность равна 0.879 г/см³. Вступает в реакции замещения:
· галогенирования, при котором атом водорода заменяется хлором или бромом, такие реакции проходят при нагревании с обязательным участием катализатора;
· нитрования (введение нитрогруппы в бензольное кольцо), итогом которой становится тяжёлая желтоватая жидкость с запахом горького миндаля – нитробензол, такая реакция может использоваться как качественная на определение;
· алкилирование галогеналканами (реакция Фриделя-Крафтса), эта реакция позволяет ввести углеводородный радикал в бензольное кольцо, и считается одним из методов получения гомологов бензола;
· алкилирование алкенами.
Бензол может вступать в реакцию горения, в результате которой образуются вода и углекислый газ.
Получение
Сейчас существует несколько методов получения бензола:
· добыча методом коксования каменного угля – активно применялась почти до середины ХХ века, бензол, полученный таким способом, не подходит для некоторых технологических процессов в современном производстве;
· методика аромаизинга бензиновых фракций нефти используется в США (в РФ и странах Европы этим методом получают половину всего бензола);
· термическое разложение тяжелых и лёгких фракций нефти – во время процесса попутно образуются толуол и ксилолы, обычно их сразу отправляют на процесс деалкилирования, и тоже получают бензол;
· тримеризация ацетилена – газ пропускают при высокой температуре над средой из активированного угля, при этом образуется бензол, плюс еще несколько ароматических углеводородов.
Важно: мировой спрос на бензол сейчас составляет более 42 млн. т, по прогнозам экспертов, к концу 2020 года эта цифра составит более 57 млн. т. Ежегодно даже рынку США не хватает ~600 тысяч тонн этого вещества.
Применение
Почему бензола требуется так много? Он необходим в производстве синтетического каучука (резина для автомобильных шин), пластмассы, синтетического волокна, красителей, ПАВ и пр. Бензол может использоваться как растворитель и экстрагент в промышленном производстве красок, его добавляют в бензин для повышения октанового числа (не более 1% по современным нормам).
Опасен ли бензол?
Влияние на человека
Это вещество является самым распространённым ксенобиотиком антропогенного происхождения (чужеродное для живых организмов вещество, не участвующее в естественном биотическом круговороте). Внимание! Бензол сильно ядовит – минимальная смертельная доза при приеме внутрь составляет всего 15 миллилитров. Он относится к веществам третьего класса опасности для человека по мировому стандарту NFPA 704 (как хлор и серная кислота). Его кратковременное воздействие может привести к серьёзным временным или умеренным остаточным последствиям. Сильный канцероген.
Горючесть
Быстро испаряется при нормальном атмосферном давлении и температуре, легко рассеивается в воздухе и легко возгорается. Температура вспышки ниже 23 °C. Поэтому по стандарту NFPA 704 это вещество имеет четвёртый класс, то есть является максимально огнеопасным.
Меры предосторожности
Работа с бензолом строго регламентируется. Во время лабораторных экспериментов его рекомендуется использовать в малом количестве (не более 50 мл). Все действия должны проводиться в защитных перчатках из фторкаучука, так же обязательна защита глаз и органов дыхания. Запрещается работать в закрытом, невентилируемом помещении, с температурой воздуха больше 30°С.
Купить бензол вы можете в магазине Химик24. Реализация оптом и в розницу.
Источник
Бензол — характеристика вещества, химические и физические свойства
Наверно каждый человек помнит о таком веществе, как бензол, еще с курса органической химии. Данное углеводородное соединение было открыто химиком Фарадеем в 1825 г., однако название «бензол» оно приобрело еще в далеком XVII веке.
Бензол является ароматическим углеводородным соединением, представляющим собой прозрачную жидкость, которая имеет слегка сладковатый запах. Структурная формула бензола — C6H6.
Это вещество является составной частью нефтепродуктов, применяется в промышленной и медицинской областях, входит в состав пластмассы, резины и различных красок.
Характеристики и физические свойства бензола
Некоторые углеводородные соединения сильно похожи на бензол. Однако они отличаются видом реакции, в которую вступают. Так, этилен, являющийся ненасыщенным углеводородом, вступает в реакцию присоединения, в то время как бензол вступает в реакцию замещения. Это происходит из-за того, что атомы бензола располагаются в одной плоскости.
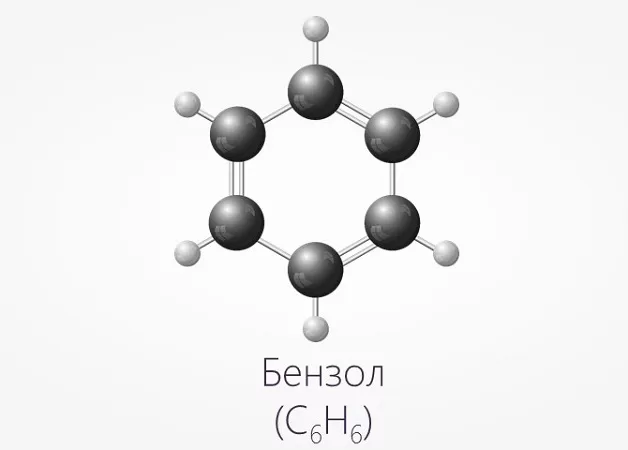
Еще одним отличием является наличие в формуле бензола бензольного кольца. Таким образом, если в химической формуле вещества имеется бензольное кольцо — однозначно это бензол.
Строение этого углеводорода представлено в виде шестиугольника.
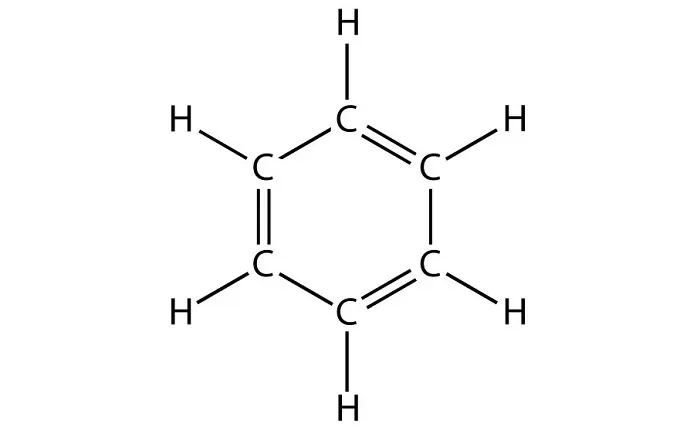
Данный углеводород имеет следующие физические свойства:
вещество представляет собой жидкость, имеющую не совсем приятный запах;
температура плавления бензола составляет 5,50C;
температура кипения — 800C;
общая плотность вещества — 0,879 г/см3;
молярная масса 78,1 г/моль;
без проблем реагирует с органическими растворителями;
при попадании воздуха образует взрывоопасное соединение;
в процессе горения на свету видны следы копчения;
растворим в воде, нагретой до 250C.
Получение бензола
Российским ученым-химиком Зелинским Н. Д. было доказано, что бензол возможно получить не только в процессе коксования угля, при котором данное сырье нагревается, выделяя бензол и иные летучие вещества. Данное вещество может быть образовано из циклогексана, в случае взаимодействия его с платиной или палладием.
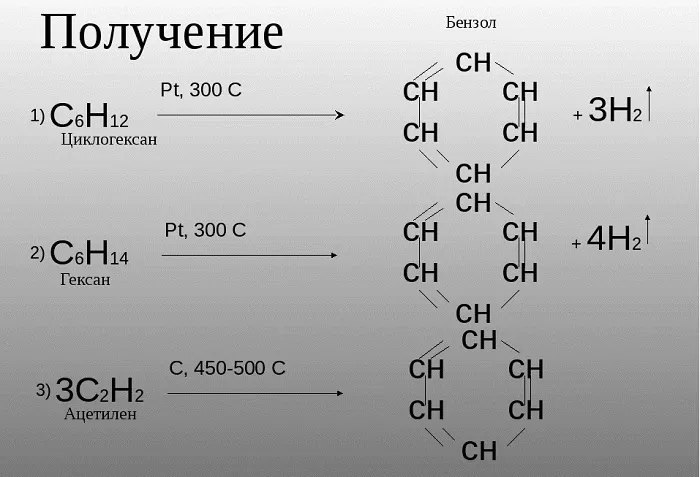
Также, бензол можно получить путем нагревания гексана.
Зелинский также считал, что бензол возможно получить путем тримеризации ацетилена:
3HС ≡ CH (Cакт., 550C) → C6H6
В настоящее время, большой популярностью пользуются такие способы получения бензола, как получение его из циклопарафинов и предельных углеводородов. Связано это прежде всего, с тем, что необходимость этого вещества сильно возросла.
Химические свойства бензола
Бензол активно вступает в реакции с кислотами, а также веществами из класса алкенов, галогенов, аренов и хлоралканов. В основном данный углеводород вступает в реакцию замещения. Высокая температура и сильное давление оказывают влияние на разрыв бензольного кольца.
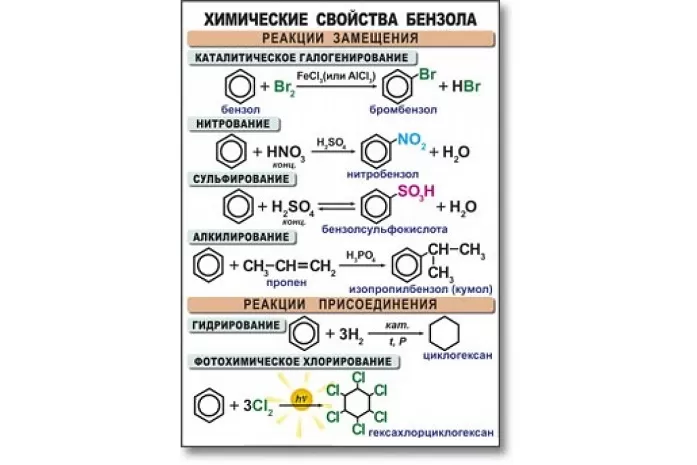
Уравнения реакции бензола:
- в случае наличия катализатора, бром вступает в реакцию с хлором, образуя при этом хлорбензол:
С6H6 + 3Cl2 → C6H5Cl + Hcl2;
- алкилирование бензола. Алкилбензол образуется в результате соединения бензола с алканами:
C6H6 + C2H5Br → C6H5C2H5 + HBr3;
- нитрование и сульфирование бензола:
C6H6 + H2SO4 → C6H5SO3H + H2O,
C6H6 + HNO3 → C6H5NO2 + H2O;
- галогенирование бензола:
С6H5 — CH3 + Br = C6H5 — CH2Br + HBr;
- к гомологам бензола относятся алкилбензолы, которые вступают в реакцию окисления, образуя при этом бензойную кислоту:
C6H5CH3 + [O] → C6H5COOH.
Применение бензола
В настоящее время бензол применяется во многих областях нашей жизни.
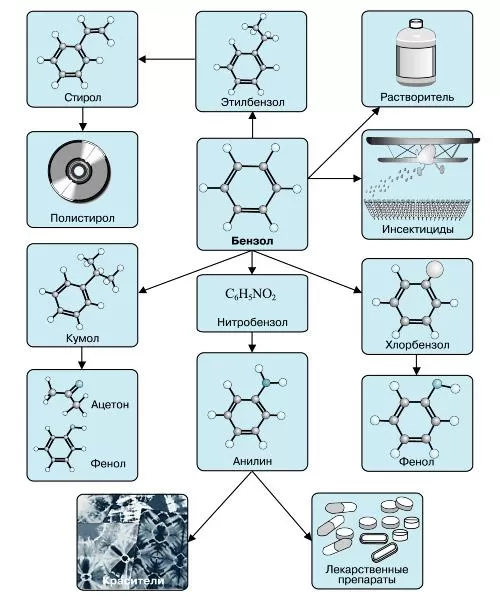
Наиболее часто данный углеводород применяется для синтезирования иных органических веществ. Используя реакцию нитрирования получают нитробензол; хлорирования — хлорбензол (растворитель), и другие вещества.
Хлорбензол часто используется в сфере сельского хозяйства, поскольку он является прекрасным средством для защиты растений. Данным веществом, при замене в его структуре молекул водорода молекулами хлора, протравливают семена растений, чтобы защитить их от грызунов и насекомых.
В области химической промышленности бензол играет немаловажную роль. Помимо его участия при создании других веществ, он также выступает в качестве растворителя. С помощью бензола возможно растворить любое органическое соединение.
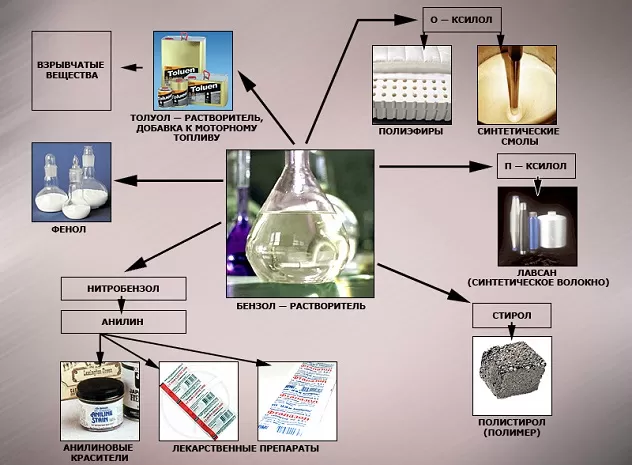
Сегодня этот углеводород чаще всего используется при синтезировании этилбензола и кумола. Однако он редко применяется в чистом виде. В основном используются его производные компоненты. Этилбензол успешно применяется в качестве одного из компонентов автомобильного топлива, а также для синтезирования ионообменной смолы.
Помимо сельскохозяйственной и химической промышленности, бензол успешно применяется в области медицины.
Впервые бензол начали применять для лечения такого заболевания, как белокровие. В начале 20 века медики всего земного шара использовали бензол для лечения лейкемии, однако вскоре выяснилось, что вылечить эту болезнь таким методом нельзя.
Сначала бензол принимали перорально, затем стали вводить в качестве инъекции. Такое его применение было связано с тем, что первоначальные исследования показали возможность данного вещества снижать уровень лейкоцитов в крови, но вскоре выяснилось, что его применение в этих целях очень опасно.
Источник
Бензол, структурная формула, химические свойства, получение
1
H
1,008
1s1
2,1
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
4,5
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
3,98
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
4,4
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,98
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
4,3
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Источник