Можно ли из алкана получить спирт
Содержание статьи
Способы получения спиртов
Гидроксисоединения – это органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Гидроксисоединения делят на спирты и фенолы.
Строение, изомерия и гомологический ряд спиртов
Химические свойства спиртов
Способы получения спиртов

Если гидроксогруппа ОН соединена с бензольным кольцом, то вещество относится к фенолам.
Общая формула предельных нециклических спиртов: CnH2n+2Om, где m ≤ n.
1. Щелочной гидролиз галогеналканов
При взаимодействии галогеналканов с водным раствором щелочей образуются спирты. Атом галогена в галогеналкане замещается на гидроксогруппу.
Например, при нагревании хлорметана с водным раствором гидроксида натрия образуется метанол
Например, глицерин можно получить щелочным гидролизом 1,2,3-трихлорпропана:

2. Гидратация алкенов
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
Например, при взаимодействии этилена с водой образуется этиловый спирт.
Гидратация алкенов также протекает по ионному (электрофильному) механизму.
Для несимметричных алкенов реакция идёт преимущественно по правилу Марковникова.
Например, при взаимодействии пропилена с водой образуется преимущественно пропанол-2.
3. Гидрирование карбонильных соединений
Присоединение водорода к альдегидам и кетонам протекает при нагревании в присутствии катализатора. При гидрировании альдегидов образуются первичные спирты, при гидрировании кетонов — вторичные спирты, а из формальдегида образуется метанол.
Например, при гидрировании этаналя образуется этанол
Например: при гидрировании ацетона образуется изопропанол
Например, гидрирование диальдегида – один из способов получения этиленгликоля
4. Окисление алкенов холодным водным раствором перманганата калия
Алкены реагируют с водным раствором перманганата калия без нагревания. При этом образуются двухатомные спирты (гликоли).
5. Промышленное получение метанола из «синтез-газа»
Каталитический синтез метанола из монооксида углерода и водорода при 300-400°С и давления 500 атм в присутствии смеси оксидов цинка, хрома и др.
Сырьем для синтеза метанола служит «синтез-газ» (смесь CO и H2), обогащенный водородом:
CO + 2H2 ⇄ CH3OH
6. Получение этанола спиртовым брожением глюкозы
Для глюкозы характерно ферментативное брожение, то есть распад молекул на части под действием ферментов. Один из вариантов — спиртовое брожение.
7. Гидролиз жиров – способ получения многоатомных спиртов
Под действием кислоты жиры гидролизуются до глицерина и карбоновых кислот, которых входили в молекулу жира.
Например: при гидролизе тристеарата глицерина образуется глицерин и стеариновая кислота

При щелочном гидролизе жиров образуется глицерин и соли карбоновых кислот, входивших в состав жира.
Например: при щелочном гидролизе тристеарата глицерина образуется глицерин и соль стеариновой кислоты (стеарат)

Источник
Получение предельных одноатомных спиртов | Химия онлайн
К наиболее часто используемым химическим способам получения спиртов относятся:
1.Гидратация алкенов (промышленный способ получения этанола для технических целей)
(t, Р, кислая среда (катализатор))
2.Щелочной гидролиз галогеналканов (лабораторный способ получения)
(водный раствор щелочи, t)
3.Восстановление альдегидов и кетонов (лабораторный способ получения)
(t, катализатор –Ni)
Особые способы получения метанола и этанола
1.Получение метанола из синтез-газа (водяной газ, генераторный газ)
(t, Р, оксидные катализаторы)
2.Получение этанола ферментативным брожением глюкозы (получение этилового спирта для пищевых и медицинских целей)
(ферменты — дрожжи)
1. Гидратация алкенов
Гидратация алкенов используется в промышленности для получения спиртов из продуктов нефтепереработки.
Присоединение воды к алкенам происходит в присутствии разбавленной серной или фосфорной кислот. Эта реакция протекает в соответствии с правилом Марковникова, поэтому первичный спирт можно получить только из этилена, а остальные алкены дают вторичные или третичные спирты: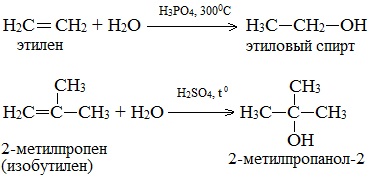
Этот метод в лабораторных условиях нашел ограниченную область применения для получения третичных спиртов.
2. Гидролиз галогеналканов в водном растворе щелочи
В лабораторных условиях спирты получают действием водного раствора щелочи на алкилгалогениды при нагревании, при этом атом галогена в галогеналкане замещается группой –ОН:
С помощью этой реакции можно получать первичные, вторичные и третичные спирты.
При действии спиртового раствора щелочи на галогеналканы происходит отщепление галогеноводорода и образование алкена.
3. Восстановление карбонильных соединений (альдегидов и кетонов)
Дегидрирование спиртов по своей химической сущности является окислением. Обратная реакция – гидрирование альдегидов, кетонов и эфиров карбоновых кислот – является, таким образом, их восстановлением.
При действии водорода в присутствии катализаторов (Ni, Pt, Pd) альдегиды восстанавливаются до первичных спиртов, а кетоны – до вторичных спиртов: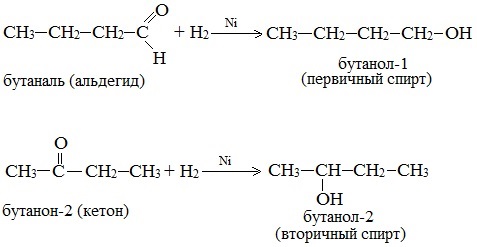
4. Восстановление эфиров карбоновых кислот
Гидрирование сложных эфиров проходит через стадию образования альдегидов:
Этим методом в промышленности из метиловых эфиров высших кислот получают высшие первичные спирты, например:
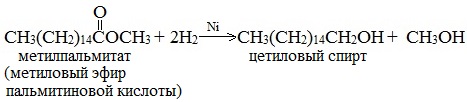
5. Гидролиз сложных эфиров карбоновых кислот в щелочной среде
Гидролиз сложных эфиров карбоновых кислот протекает как в кислой, так и в щелочной среде (водные или спиртовые растворы NaOH, КОН, а также Ba (OH)2, Ca (OH)2, Ba (OH)2, Ca (OH)2). Однако к образованию спиртов приводит гидролиз, протекающий необратимо в щелочной среде:
6. Синтез спиртов из карбонильных соединений с помощью магнийорганических соединений
Спирты образуются при многочисленных реакциях металлоорганических соединений с различными соединениями, содержащими карбонильную группу >С=О. Этим способом можно получать как первичные спирты, так и вторичные и третичные:
7. Окисление алканов
При мягком окислении метана кислородом воздуха в присутствии различных катализаторов образуются метанол, формальдегид или муравьиная кислота:
Специфические способы получения метанола и этанола
Производство метанола крупнотоннажное, т.к. метиловый спирт является исходным веществом для получения других продуктов органического синтеза.
В промышленности
1. Получение метанола из синтез-газа (водяной газ, генераторный газ)
а) Конверсия природного газа в синтез-газ
Его получают из метана с перегретым водяным паром:
б) Каталитический синтез метанола из оксида углерода (II) и водорода
В качестве катализаторов используют смесь оксидов цинка, меди и хрома, температуру поддерживают в интервале 200-300 оС, а давление – от 40 до 150 атм.
Газ на выходе из реактора содержит 3-5% CH3OH, затем газ охлаждают и конденсируют полученный метанол, а оставшийся газ смешивают с исходным газом и направляют снова в реактор.
Ранее метанол получали сухой перегонкой древесины без доступа воздуха (отсюда его название «древесный спирт»).
2. Получение этанола спиртовым брожением глюкозы
Ферментативный гидролиз крахмала – наиболее древний синтетический процесс, используемый человеком – до сих пор имеет огромное значение для получения этилового спирта.
Протекает только в присутствии ферментов, которые вырабатывают некоторые микроорганизмы, например, дрожжи:
Глюкоза содержится во фруктовых соках. Глюкозу можно получить гидролизом крахмала (зерно, картофель, целлюлозные опилки):
Предельные одноатомные спирты
Источник
Способы получения спиртов
Высокий уровень развития науки химии и инновационные технологии позволили применять различные способы получения спиртов. Статистические данные свидетельствуют о росте спроса на производство данных видов органических соединений в промышленных масштабах.
К спиртам относят вещества, химическая формула которых включает гидроксильные группы (ковалентно связанные атомы кислорода и водорода — НО).
В зависимости от количества гидроксилов выделяют:
Одноатомные спирты — получают путем преобразования предельных углеводородов (алканов). Виды одноатомных органических соединений: пропанол 1 и 2; метанол; этанол и другие.
Полиолы (многоатомные спирты), к которым относятся: двухатомные (гликоли). Диол этиленгликоль выделяют из этилена. Триол (глицерин) относится к трёхатомным спиртам.
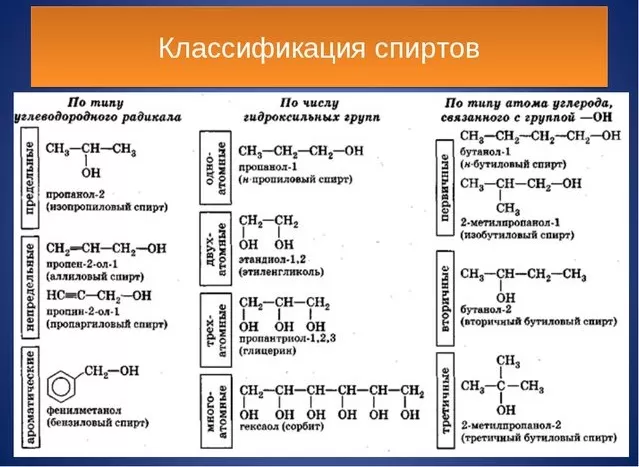
Классифицируют органические соединения по виду углеводородных радикалов: предельные, непредельные, ароматические.
Различают по месту привязки гидроксильной группы в молекулярной цепи: первичные, вторичные и т. д.
Свойства зависят от всех элементов молекулярного строения в совокупности.
Химические способы получения спиртов
Получают двумя основными способами: химическим (синтетические спирты) и биохимическим (биоспирты).
От метода получения, исходного сырья зависят свойства вещества, его целевое использование в промышленном, пищевом производстве. Для первого вида основным сырьём служит древесина и нефтепродукты. Этанол, полученный из этих продуктов в качестве технического спирта, используют в химическом, промышленном производстве. Он содержит определённое количество вредных примесей.
Применение биохимического способа предполагает использование в качестве исходного сырья продуктов растительного происхождения. Этим способом получают медицинский, пищевой этанол.
Получение спиртов из галогеноуглеводородов
Гидролиз галогенопроизводных происходит на основе реакции нуклеофильного замещения. Реагент на внешнем уровне молекулы имеет неопределённые пары электронов, которые отрываются и перестраивают молекулярную решётку.
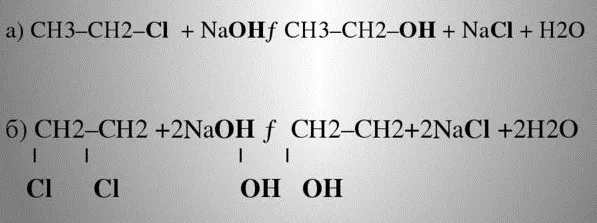
Под воздействием паров воды, щелочного раствора (реагента), температуры, галоген замещается гидроксилом, образуется спиртосодержащее органическое соединение.
Щелочной гидролиз галогеноалкенов — промышленный способ получения технического этанола из этилена.
Получение спиртов из алкенов
Алкены — этиленовые углеводороды. К ним относят бутен, этилен, пропилен и т. д. Их молекулярная цепочка включает двойную связь атомов углерода (Н₂С).
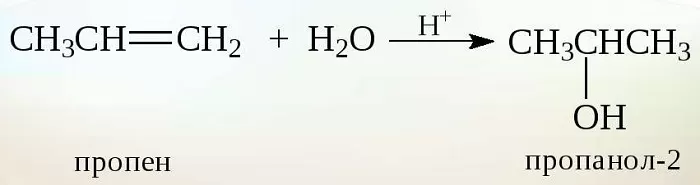
Существует два основных способа получения алкенов:
методом крекинга углеводородов (нефти и газа);
методом дегидратации.
В зависимости от вида алкенов, в условиях высокой температуры (ориентировочно 300⁰С), давления (до 70 атмосфер) из водных растворов кислот образуются спирты. В промышленном производстве чаще в качестве реагента выступает ортофосфорная кислота.
Этот способ подходит для производства этилового и вторичных спиртов. К примеру из пропилена получают пропанол 2.
Получение из простых алкенов и спиртов
Спиртосодержащие органические соединения получают в результате реакции гидроборирования. Первичное сырьё (алкены) под воздействием раствора перекиси водорода гидролизуются, получают спирты.
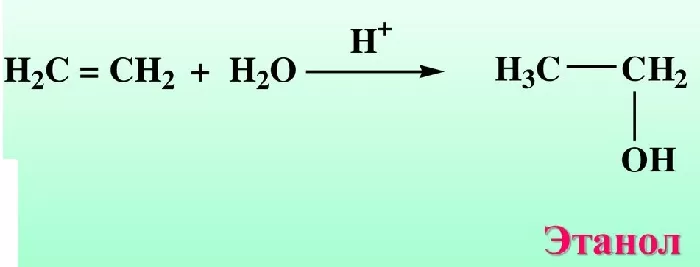
Гидратация — процесс сложный. Он происходит в два этапа:
Сначала алкены вступают в реакцию с дибораном (вещество, включающее водород и бор), образуется вещества под названием «алкибораны».
Промежуточное соединение вступает в реакцию со щелочным раствором перекиси водорода.
Гидроборирование — быстрый и удобный способ получения первичных спиртов. Подобный процесс происходит при нагревании вторичных спиртов, обработки их щелочными растворами перекисью водорода.
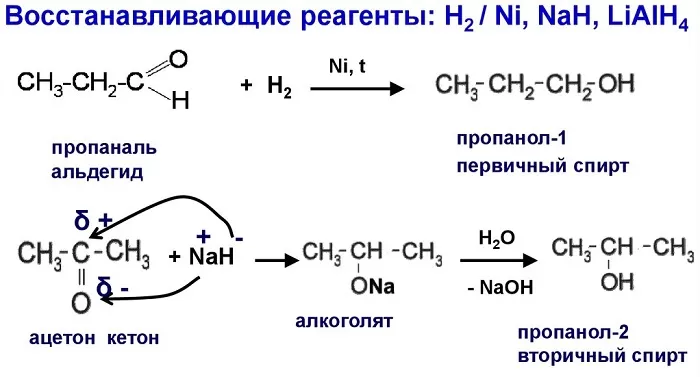
Получение спиртов из альдегидов и кетонов
Альдегиды и кетоны — вещества, в составе которых присутствует карбонильная группа (-СНО). У альдегидов –СНО связан с водородом и одним углеводородным радикалом. У кетонов 2 связи – СНО с радикалами.

Восстановление молекулы спирта происходит при нагревании с использованием никелевого катализатора. Реакция восстановления позволяет получать из альдегидов первичные спирты, из кетонов — вторичные.
Получение спиртов из карбоновых кислот и сложных эфиров
Процесс превращения карбоновых кислот, сложных эфиров в спиртоорганические соединения основан на реакции гомологизации. В результате дополнения метиленовых групп к молекулам кислот, эфиров образуются гомолог, спирт. Катализаторами процесса выступают алюмогидрид лития.
Сложный процесс проходит в несколько этапов:
Сначала в эфирную суспензию добавляется карбоновая кислота.
Смесь охлаждается.
Её разделяют на фракции при помощи кислот, щелочных растворов.
Характерно, что это процесс взаимообратный. Из спиртосодержащих веществ синтезируют карбоновые кислоты, сложные эфирные соединения.
Получение спиртов восстановлением эпоксидов и карбонильных соединений
Оксираны (эпоксиды) или эпоксидные соединения — простые эфиры циклической формы с атомом кислорода.
Под воздействием реагентов литийдиалкилкупратов происходит разрыв кольцевой структуры молекулы, образуются молекулы органических спиртосодержащих соединений.
Исходным сырьём для получения служат карбоновые кислоты и их производные, эфиры, кетоны. Металлоорганические соединения кадмия, ртути, алюмний бромид, диалкилкупраты щелочных металлов — они вступают в реакцию с исходными компонентами (метод Гильмана). В качестве растворителя используют чаще хлористый метилен. Реакция происходит при низких температурах.
Получение спиртов окислительными методами
Используется несколько методик преобразования ненасыщенных спиртов с использованием разных реагентов и апротонных растворителей. Последние способны растворять ионные реагенты.
Способы:
окисление диоксидом марганца + органический растворитель;
с использованием пентана, хлористого метилена;
окислители на основе хрома (6 валентного), марганца (6-7 валентного).
Процент выхода зависит от типа используемого реагента.
Другие способы получения спиртов
Существуют и другой способ — биохимического брожения сырья растительного происхождения. Лучше всего для этих целей подходят продукты с высоким содержанием сахара, клетчатки, крахмала. Под воздействием дрожжей, отдельных видов бактерий, плесневых грибов происходит брожение массы.
В сусле углеводы биомассы разделяются на углекислый газ, воду и этанол. Методом дистилляции выделяют его из перебродившего сусла. После ректификации (очищения), чистота этанола составляет 95-100%. Класс пищевого спирта определяет степень очистки, исходное сырьё для его производства.
Множество способов получения спиртов обусловлено широким спектром спиртосодержащих соединений и их свойствами.
Источник
Из алкана получить спирт
4.5. Получение алкенов
В природе алкены встречаются в значительно меньшей степени, чем предельные углеводороды, по-видимому, вследствие своей высокой реакционной способности. Поэтому их получают с использованием различных реакций.
I. Крекинг алканов: Например:
II. Отщепление (элиминирование) двух атомов или групп атомов от соседних атомов углерода с образованием между ними p -связи.
- Дегидрогалогенирование галогеналканов при действии спиртового раствора щелочи
Дегидратация спиртов при повышенной температуре (выше 140 ° C) в присутствии водоотнимающих реагентов
Реакции элиминирования идут в соответствии с правилом Зайцева:
Отщепление атома водорода в реакциях дегидрогалогенирования и дегидратации происходит преимущественно от наименее гидрогенизированного атома углерода.
Современная формулировка: реакции отщепления идут с образованием более замещенных при двойной связи алкенов.
Такие алкены обладают более низкой энергией.
Дегалогенирование дигалогеналканов, имеющих атомы галогена у соседних атомов углерода, при действии активных металлов :
Чтобы предотвратить превращение альдегида в кислоту, его отгоняют в ходе реакции (т. кипения альдегида, не образующего межмолекулярные водородные связи, ниже т.кип. спирта и кислоты)
При окислении вторичных спиртов образуются кетоны
2 . В промышленности альдегиды и кетоны получают дегидрированием спиртов, пропуская пары спирта над нагретым катализатором (Cu, соединения Ag, Cr или Zn).
Этот способ позволяет получать карбонильные соединения, в особенности альдегиды, без побочных продуктов окисления.
3. Гидротация алкинов (реакция Кучерова)
присоединения воды к ацетилену в присутствии солей ртути приводит к образованию ацетальдегида:
Кетоны получают при гидротации других гомологов ряда алкинов:
К альдегидам относятся важнейшие моно- и олигосахариды — глюкоза, лактоза и др. Содержатся А. в эфирных маслах, напр. цитраль — в лемонграссовом (до 80%) и кориандровом маслах, цитронеллаль — в цитронелловом (
30%) и эвкалиптовом, бензальдегид — в масле горького миндаля; плоды ванили содержат 1,5-3% ванилина.
Ацетальдегид производят гл. обр. окислением этилена, а также каталитической гидратацией ацетилена (р-ция Кучерова), акролеин — окислением пропилена, пропионовый и масляный альдегиды — гидроформилированием соотв. этилена и пропилена. А. синтезируют в пром-сти также каталитич. восстановлением карбоновых к-т (гл. обр. высших) муравьиной к-той, гидролизом дигалогенозамещенных углеводородов.
Методы получения альдегидов:
методы окисления или дегидрирования:
дегидрирование спиртов над катализаторами (Ag, Cu) — используется в основном в промышленности;
окисление спиртов хроматами, комплексами триоксида хрома (VI), диметилсульфоксидом, церийаммонийнитратом, иодозобензолом;
восстановление хлорангидридов кислот через соединения Рейсерта;
введение карбонильной группы (формилирование):
гидролиз и расщепление:
присоединение и конденсации:
В промышленности предельные углеводороды получают из нефти фракционированием или крекингом. Перегонка позволяет выделить алканы, изначально присутствующие в нефти, при крекиге происходит разрыв С-С связей, в результате чего образуются углеводороды меньшей молекулярной массы, чем исходные. Низшие гомологи алканов зачастую получают из природного газа. Лабораторные способы можно разделить на три группы:
- 1. Образование алкана с сохранением углеродного скелета исходной молекулы.
- а) гидрирование непредельных углеводородов
К реакциям восстановления относят и реакции получения предельных углеводородов из непредельных, т.е. содержащих двойные и тройные связи. Здесь речь идет о непосредственном присоединении атомов водорода (реакции гидрирования), например:
Эти реакции также протекают при действии таких восстановителей, как иодистоводородная кислота, но могут идти и с газообразным водородом. Однако в последнем случае, вследствие инертности водорода при обыкновенной температуре, приходится прибегать к помощи катализаторов. Наиболее сильными из них являются металлы группы платины в мелко раздробленном состоянии, особенно сама платина, палладий и осмий.
б) восстановление йодалканов
Восстановление йодалканов происходит при нагревании последних с йодоводородной кислотой:
в) замена галогенпроизводных на водород
При каталитическом гидрировании в присутствии палладия галогеналканы превращаются в алканы:
R—CH2Cl + H2 > R—CH3 + HCl
г) восстановление карбонильных соединений (реакции Кижнера-Вольфа и Клемменсена)
Реакцию Кижнера-Вольфа проводят в избытке гидразина в высококипящем растворителе в присутствии KOH.
Реакция Клемменсена (восстановление по Клемменсену)- восстановление карбонильной группы альдегидов и кетонов до метиленовой (дезоксигенирование) под действием амальгамы цинка в соляной кислоте. Реакцию проводят при кипячении карбонильного соединения и Zn/Hg с избытком НСl в присутствии органического растворителя или без него.
д) гидролиз (сольволиз) реактивов Гриньяра.
При прибавлении раствора алкилгалогенида в сухом диэтиловом эфире (C2H5)2O к металлическому магнию при перемешивании происходит бурная реакция; раствор мутнеет, начинает кипеть, а металлический магний постепенно исчезает. Получающийся раствор называется реактивом Гриньяра по имени Виктора Гриньяра (Лионский университет), который в 1912 г. получил за это открытие Нобелевскую премию. Это один из наиболее полезных и многосторонних реагентов, известных химику-органику.
Реактив Гриньяра имеет формулу RMgX и общее название алкилмагний-галогенид. Считается, что связь углерод — магний является ковалентной, но сильно полярной, связь магний — галоген по существу ионная [4].
е) Восстановление спиртов
Восстановление спиртов приводит к образованию углеводородов, содержащих то же количество атомов С. Так, например, проходит реакция восстановления бутанола (C4H9OH), проходящую в присутствии LiAlH4. При этом выделяется вода.
ж) Разложение карбидов металлов (метанидов) водой:
2) Реакции, протекающие с укорочением углеродной цепи.
Декарбоксилирование карбоновых кислот заключается в отщеплении от молекулы карбоновой кислоты карбоксильной группы, протекающем согласно следующей общей схеме:
Наиболее известны реакции декарбоксилирования уксусной и бензойной кислот, которые проводят нагреванием до высокой температуры смеси соли карбоновой кислоты и щелочи [5]:
- 3) Получение алканов с более длинной цепью, чем исходные соединения.
- а) Взаимодействие галогеналканов с металлическим натрием или калием (реакция Вюрца)
Реакция Вюрца, или синтез Вюрца — метод синтеза симметричных насыщенных углеводородов действием металлического натрия на алкилгалогениды (обычно бромиды или хлориды). Приводит к увеличению углеводородной цепи (суммированию углеводородных радикалов и объединению в один больший):
б) электролиз солей карбоновых кислот (реакция Кольбе)
Электролиз солей одноосновных органических. В растворах соли одноосновных органических кислот распадаются на ионы:
При электролизе ион металла, теряя на электроде заряд, действует на воду с выделением водорода и образованием едкой щелочи, а ион кислотного остатка, потеряв свой заряд, распадается на радикал R· и двуокись углерода СО 2. Два радикала R· соединяются в молекулу R—R.
в) Взаимодействие диалкиллитий купратов или других металлорганических соединений с активными алкилгалогенидами.
Источник